Más pequeño es mejor: Mejore los resultados de los análisis de micotoxinas reduciendo el tamaño de las partículas
Publicado en:
Micotoxinas
Este artículo fue publicado en Spot On #13
¿Tiene curiosidad por ver qué le ofrece Spot On?
Lee ahora
Las últimas investigaciones están demostrando que el tamaño de las partículas de una muestra tiene un efecto considerable en la precisión de los métodos analíticos de micotoxinas. Las expertas en micotoxinas Henriette Hobbs y Nora Kogelnik dimensionan el problema y ofrecen algunas recomendaciones para que sus operaciones de análisis de micotoxinas sigan siendo precisas y fiables.
Publicado en:
Micotoxinas
Este artículo fue publicado en Spot On #13
¿Tiene curiosidad por ver qué le ofrece Spot On?
Lee ahora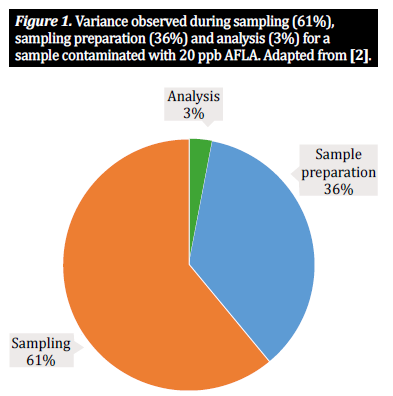
En la comunidad analítica de micotoxinas, generalmente trabajamos con tres pasos principales de procedimiento cuando se trata de productos agrícolas como el maíz, el trigo y la cebada: muestreo, preparación de la muestra y análisis. Para determinar la concentración de micotoxinas presente en un lote a granel, debemos analizar una porción más pequeña pero aún representativa del lote; esto significa que es imposible obtener resultados fiables sin un plan de muestreo adecuado, que incluya la toma de muestras incrementales del lote y su combinación en una submuestra (también conocida como muestra a granel). Esto constituye una base que garantiza que la muestra que se va a analizar es realmente representativa del lote. A partir de aquí, nuestra atención se centra en la preparación de la muestra. En el caso de los productos a base de granos, la preparación de la muestra consta de dos pasos importantes: la molienda de la muestra y el submuestreo: 1) se utiliza un molino u otro dispositivo para moler el grano de la muestra a granel con el fin de reducir el tamaño de las partículas y garantizar la uniformidad; 2) a partir de esta muestra, obtenemos una submuestra representativa de todo el lote, que sometemos a prueba. Esta muestra de prueba se prepara posteriormente para la extracción según un protocolo definido [10]. Sin embargo, el muestreo y la preparación de la muestra son procesos complejos, plagados de escollos potenciales; cada paso dentro del proceso de preparación de la muestra introduce un nivel de variabilidad que contribuye a la variabilidad total dentro de un único resultado analítico [2, 5]. Numerosos estudios han demostrado que dos tercios de la variabilidad observada se deben al método de muestreo, y un tercio es atribuible a la forma en que se prepara la muestra. Un porcentaje mucho menor de variabilidad está relacionado con el método analítico aplicado (figura 1). Por consiguiente, la precisión de los resultados depende del grado en que tengamos en cuenta estos tres factores. Aunque numerosos estudios discuten la importancia de los métodos de muestreo y de los disolventes analíticos en el efecto de la detección de micotoxinas (véanse [1, 2, 4] ejemplos destacados), en este artículo se considerará la importancia de la preparación de la muestra, es decir, la molienda y el tamaño de la muestra, y, resumiendo investigaciones recientes sobre la materia, se discutirá el efecto que tiene la preparación de la muestra en la precisión del análisis de micotoxinas y en la varianza de la muestra [10].
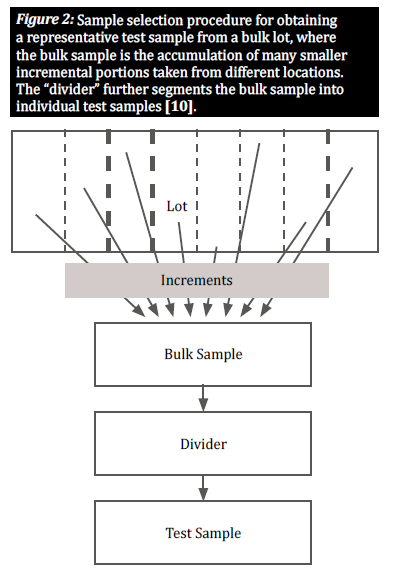
Seleccionar una muestra representativa
Cuando una mercancía se contamina de forma natural con micotoxinas, los granos contaminados suelen distribuirse de forma desigual en un determinado lote; estas agrupaciones de granos contaminados se conocen como "puntos calientes". Para proporcionar una visión precisa del grado de contaminación de un lote, un plan de muestreo debe tener en cuenta la distribución aleatoria de dichos puntos calientes. Esto se hace tomando un gran número de pequeñas muestras incrementales de varios lugares distribuidos por todo el lote para obtener una muestra representativa (figura 2) [8]. La selección de muestras incrementales de un lote a granel es crucial para dar a todos los granos la misma oportunidad de ser seleccionados, reduciendo así el sesgo [10].
Molienda para garantizar un tamaño de partícula uniforme
Los mohos que producen micotoxinas tienen varias vías diferentes de contaminación; como resultado, las micotoxinas pueden encontrarse tanto en el interior de los granos como en la superficie. La vía de infección depende de la micotoxina y del grano en cuestión. Es bien sabido que ciertos hongos productores de micotoxinas, como el Fusarium, están presentes en el interior del grano o la semilla, mientras que otros, como el Aspergillus, lo están en la superficie. Moler una muestra de manera uniforme resuelve este problema al romper los granos contaminados y permitir una distribución uniforme de las partículas. En última instancia, esto mejora la detección de partículas contaminadas [3].
Homogeneizar la distribución potencial de micotoxinas pasando el grano por una malla y mezclándolo
Tras seleccionar la muestra para que sea representativa del lote y molerla para garantizar un tamaño de partícula uniforme, es necesario homogeneizar la muestra mezclándola a fondo; esto también ayuda a que sea representativa de la muestra a granel [3]. Los granos se segregan según su tamaño, lo que reduce el grado de representatividad de la muestra y conduce a un resultado analítico inexacto. Por esta razón, antes de mezclar, confirmamos que la uniformidad de la molienda es adecuada pasando la muestra molida por una malla o un tamiz. El objetivo no es filtrar las partículas más grandes, ya que también pueden contener micotoxinas; al contrario, estas partículas más grandes deben incluirse en la muestra. Se trata más bien de garantizar la uniformidad de la molienda comprobando que un determinado porcentaje de partículas es capaz de pasar. El USDA-FGIS, por ejemplo, ha establecido especificaciones para el tamaño de la muestra, la molienda de la muestra y el submuestreo para aflatoxina, deoxinivalenol, fumonisina, ocratoxina y zearalenona [9]. El USDA-FGIS recomienda moler la muestra de forma que el 60-75% de las partículas pasen por un tamiz nº 20 y utilizar 50 g de muestra de ensayo (incluidas las partículas que no pasan por el tamiz) para la extracción de la micotoxina.
Mantenga un tamaño de grano pequeño, un tamaño de muestra grande y unos resultados de micotoxinas precisos
Utilizamos los términos "exactitud" y "precisión" a lo largo de este artículo, por lo que conviene dar aquí una definición rápida de estos términos: exactitud y precisión significan incertidumbres asociadas al análisis que pueden introducirse a partir del método o plan inicial de preparación de la muestra. La exactitud se define como la proximidad de un valor medido al valor verdadero, mientras que la precisión se define como la proximidad de los valores medidos entre sí. El objetivo final debe ser aplicar un proceso que garantice tanto una alta exactitud como una alta precisión [10]. Los estudios demuestran que la precisión de un método de detección de micotoxinas y, por tanto, la varianza de los resultados dependen en gran medida del tamaño de las partículas de la muestra. Para demostrar la variabilidad de la medición asociada al tamaño de las partículas dentro de la muestra y al tamaño de la muestra analizada, nos remitimos a varios estudios que la evaluaron (figura 3 y figura 4). En el primer estudio realizado por Whitaker et al. (mostrado en la figura 3), se caracterizaron muestras de maíz contaminadas naturalmente por aflatoxina. Posteriormente, las muestras de granos de distintos tamaños se pasaron por un tamiz del nº 20. Las muestras se sometieron a un proceso de molturación en el que se obtuvieron los siguientes resultados 1) una molienda gruesa (pasó el 60% de las partículas), 2) una molienda fina (pasó el 99% de las partículas) y 3) pulverizadas (con un molino de martillos). A continuación, se analizaron ocho muestras de cada intervalo de molienda utilizando un método de referencia HPLC modificado para demostrar la varianza entre muestras dentro de un mismo estado molido [9].
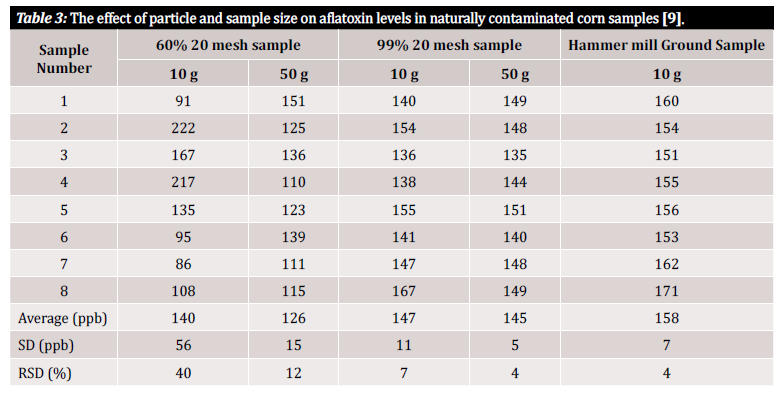
Como puede ver en la tabla 3, hay variación en los resultados analíticos dependiendo tanto del tamaño de la muestra como del tamaño de la molienda. Sin embargo, ¿cómo podemos cuantificar esta variación de forma que nos resulte útil? La desviación estándar relativa (RSD) o el coeficiente de variación (CV) se utilizan a menudo para determinar lo disímiles que son los resultados de un conjunto de datos concreto. La RSD suele declararse en forma de porcentaje y se define por la relación entre la desviación típica y la media. Cuanto menor sea la desviación estándar, menor será la variación dentro del conjunto de datos y más fiable será el resultado. En los datos del estudio representados en la tabla 3, se observó una variabilidad significativa entre las muestras de 10 g compuestas por partículas de diferentes tamaños. Las muestras de 10 g de molido grueso muestran en un 40% la RSD más alta en comparación con la muestra de molido más fino (99% de la muestra de malla 20), con una RSD calculada del 7%. La RSD más baja, del 4%, se alcanzó con las muestras pulverizadas del molino de martillos. Aunque un molino de martillos no suele ser económicamente viable para el probador medio, el estudio de Whitaker et al. demuestra que la mejor manera de evitar la varianza procedente de la preparación de las muestras es moler finamente y utilizar una malla para garantizar la uniformidad del tamaño de las partículas [9].
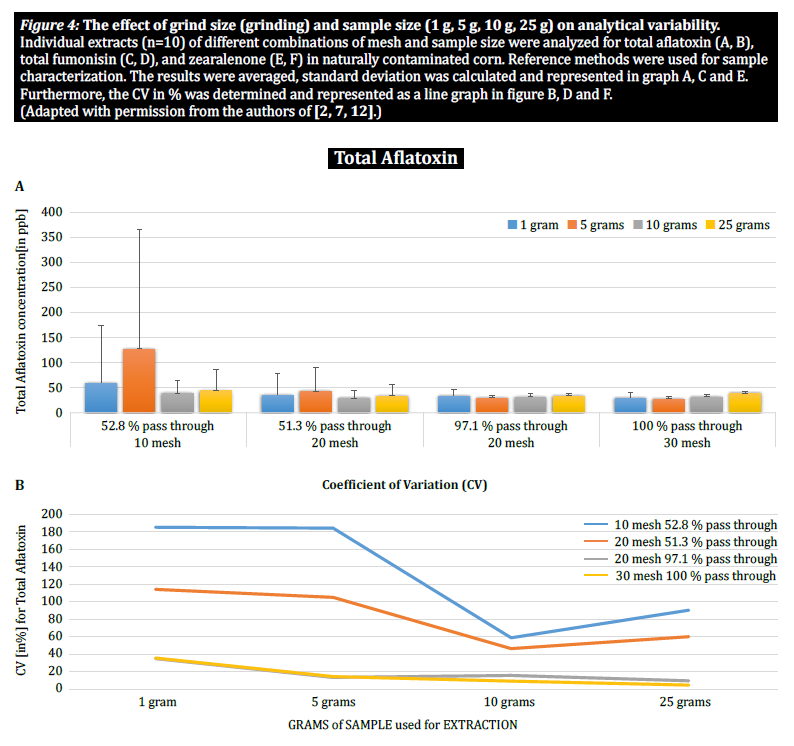
Para demostrar aún más el impacto del tamaño de las partículas (molienda) y de la muestra en la variabilidad analítica entre diferentes micotoxinas, Brunkhorst et al. realizaron un análisis de muestras de maíz contaminadas de forma natural con aflatoxina total (suma de B1, B2, G1 y G2), fumonisina total (suma de B1, B2 y B3) o zearelenona (figura 4). Para este estudio, se molieron 10 muestras de maíz para cada micotoxina con diferentes tamaños de partícula para permitir que pasaran a través de un tamiz no. 10, un tamiz n.º 20 o un tamiz n.º 30. También se investigó la varianza de diferentes tamaños de muestra (1 g, 5 g, 10 g y 25 g) para la extracción. Las muestras de aflatoxinas se extrajeron con acetonitrilo/agua (84/16) y se analizaron utilizando un método AOAC y una célula KOBRA para la bromación postcolumna. Las muestras de fumonisina se extrajeron con metanol/agua (3/1) y también se analizaron según el método de la AOAC. Las muestras de zearealenona también se extrajeron con acetonitrilo/agua y se analizaron mediante LC-MS/MS. Nota: Los datos mostrados en cada par de gráficos son algo redundantes. Sin embargo, nos parece útil representar el coeficiente de variación en un gráfico separado. Los resultados muestran claramente que el tamaño de la molienda y el tamaño de la muestra influyen en la precisión del análisis. El estudio sugiere que AFLA y ZON muestran un mayor grado de dependencia (es decir, un CV más alto) del volumen de la muestra y del tamaño de la molienda que FUM, aunque dudamos en extraer una conclusión firme de estos estudios individuales; se necesita más investigación para confirmar nuestra observación. Para tamaños de muestra de 1 g y 5 g, las RSD para AFLA, FUM y ZON fueron mayores en comparación con tamaños de muestra de 10 g y 25 g. La variabilidad observada para una muestra de 10 g de maíz contaminado con AFLA disminuyó del 58,9% (molido grueso) al 9,3% (molido fino), para FUM del 39,8% (molido grueso) al 4,6% (molido fino), y para ZON del 21% (molido grueso) al 2% (molido fino). Estos resultados afirman aún más el efecto del tamaño de la molienda en la varianza y la precisión analíticas con respecto a la extracción y el análisis de micotoxinas de los granos.
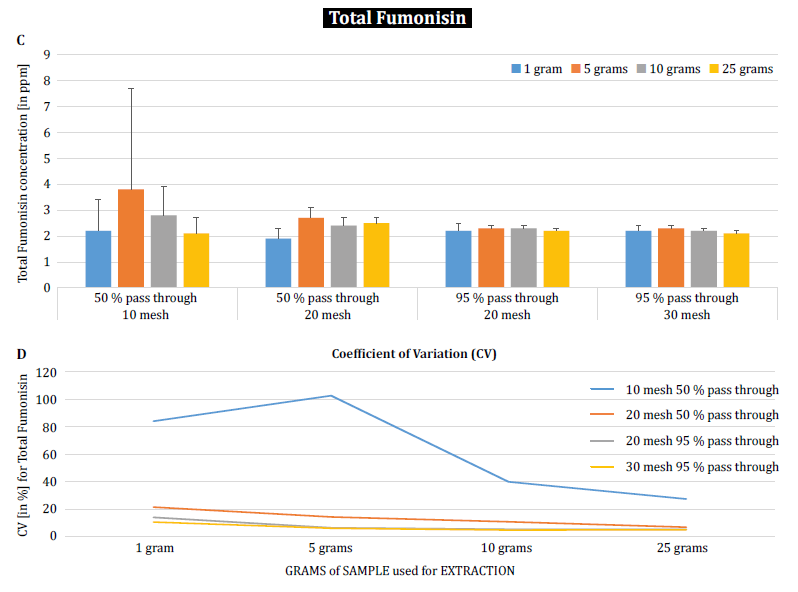
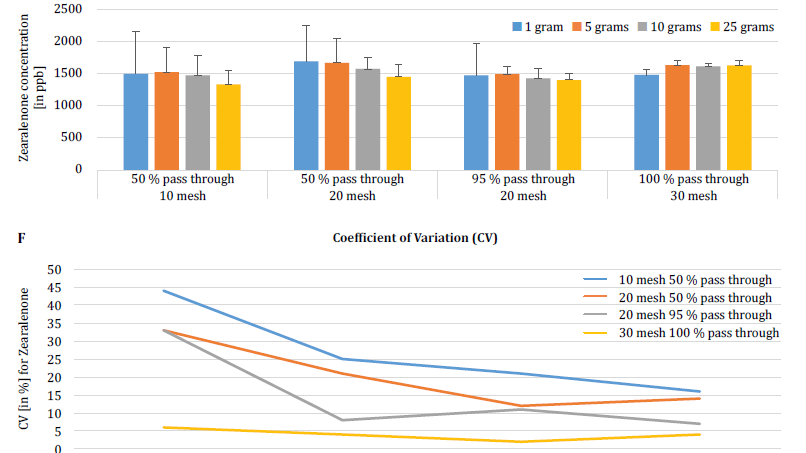
Por último, Brunkhorst et al. elucidaron aún más sus hallazgos y determinaron los niveles de deoxinivalenol en muestras de cebada contaminadas de forma natural con el mismo esquema de estudio. Las muestras de cebada se molieron en cuatro tamaños de malla diferentes, se extrajeron (10 extractos individuales en cada tamaño de malla y muestra) utilizando acetonitrilo/agua (84/16) y se analizaron por LC-MS-MS (figura 5) [6]. Los resultados demuestran claramente que la variabilidad analítica puede reducirse cuando las muestras se muelen para que pasen por un tamaño de malla más fino. Además, el aumento del tamaño de la muestra ayuda aún más a reducir la variabilidad analítica. El coeficiente de variación pudo reducirse del 11% a sólo el 5% cuando se utilizó una muestra de 10 g con una malla no. 10 de malla. Un tamaño de muestra de 10 g y 25 g en combinación con una malla n.º 20 (95%) y n.º 30 (95%) proporciona resultados exactos y precisos, reduciendo el CV al 5% y al 3%, respectivamente. Como en este estudio se utilizó cebada en lugar de maíz, sugiere que el efecto del tamaño de la muestra y de la molienda sobre la variabilidad analítica de las micotoxinas puede no depender de la matriz. Es necesario realizar más estudios para confirmarlo [6].
Conclusión: Moler, mezclar, repetir según sea necesario
Es evidente la importancia de la molienda y el tamaño de la muestra, así como el impacto que estos factores tienen en la reducción de la variabilidad y la minimización de los errores durante el análisis de micotoxinas. En los estudios presentados, se observó una variación significativa entre las muestras molidas gruesa y finamente de la misma fuente y nivel de contaminación. Más allá de la simple observación de la variación, los datos de estos estudios sugieren algunos planteamientos iniciales sobre el tamaño de la muestra y la molienda. En cuanto al tamaño de la muestra, 10 g han demostrado ser suficientes, mientras que 25 g pueden proporcionar una precisión aún mayor. Cuando se utiliza una malla del n.º 20, debe pasar el 95% de la muestra. Si utiliza una malla n.º 30, debe pasar el 100%. El principal objetivo del análisis de micotoxinas es obtener resultados precisos y fiables a pesar de las dificultades del muestreo y las complejidades de la preparación de las muestras de grano y cultivos. Sin embargo, incluso la mejor tecnología, ya sea en forma de pruebas rápidas de última generación o de equipos de espectrometría de masas de alta precisión, no servirá de nada si su muestra no es representativa del lote examinado. Para que una muestra sea representativa hay algo más que el mero muestreo; la preparación de la muestra es clave. Si se atiene a los tres factores clave de la preparación de la muestra (tamaño de la molienda, tamaño de la muestra y homogeneidad), podrá mantener su RSD en <10%, aumentando la fiabilidad de su resultado analítico.