Retour à la bibliothèque Romer
Au-delà des tests immunologiques sur les allergènes
Publié le :
Allergènes alimentaires

La plupart des kits disponibles dans le commerce pour la recherche d'allergènes alimentaires reposent sur l'application de méthodes immunologiques telles que l'ELISA ou les dispositifs à flux latéral (tests en bandelettes). L'ELISA nécessite un personnel qualifié, mais de nombreux échantillons peuvent être analysés en parallèle en utilisant des plaques de microtitration à 48 ou 96 puits. En général, l'analyse peut durer de 30 minutes à quelques heures. À l'heure actuelle, la méthode ELISA est la plus largement appliquée pour la détection et la quantification des allergènes alimentaires. Cependant, bien que de nombreux échantillons puissent être analysés en même temps, ces échantillons ne peuvent être testés que pour un seul analyte.
Limites à prendre en compte
En raison de la grande spécificité des anticorps vis-à-vis d'une seule protéine allergène particulière et des limitations liées à la technologie, un kit distinct doit être utilisé pour chaque allergène. En outre, le degré élevé de spécificité à l'égard d'un allergène peut conduire à des résultats faussement négatifs. Les étapes de transformation des aliments, telles que le traitement thermique, l'ajout de composés acides ou la fermentation, peuvent modifier la structure de la protéine cible. Ces allergènes modifiés peuvent perdre leurs propriétés immunologiques et le complexe anticorps-protéine cible ne peut plus se former. Cela conduit à des résultats faussement négatifs ou à des quantifications réduites. Les tests en bandelettes sont peu coûteux, très faciles à utiliser, ne nécessitent pas d'équipement de laboratoire et donnent généralement des résultats en quelques minutes. Cependant, la plupart des tests en bandelettes sont uniquement qualitatifs et reposent sur des anticorps comme éléments de reconnaissance. Ils souffrent donc des mêmes problèmes que les tests ELISA pour les aliments hautement transformés. Ces dernières années, d'autres méthodes d'analyse ont été mises au point pour surmonter au moins certaines des restrictions des systèmes de tests immunologiques.
Détection des allergènes par l'ADN
La PCR (réaction en chaîne de la polymérase) est une méthode relativement rapide et peu coûteuse d'identification de l'ADN. Cette technologie, mise au point dans les années 1980, n'a cessé de s'améliorer depuis. La PCR est utilisée depuis de nombreuses années dans les domaines du diagnostic médical, de la médecine légale, de la surveillance de l'environnement et de la quantification des organismes génétiquement modifiés dans les denrées alimentaires et les aliments pour animaux. Au début des années 2000, la PCR a été utilisée pour la première fois pour identifier l'ADN d'allergènes alimentaires courants tels que la noisette et l'arachide. Jusqu'à présent, des tests PCR ont été publiés pour la plupart des "huit grands" allergènes alimentaires des États-Unis et des 14 allergènes alimentaires de l'UE. La PCR amplifie de petits fragments d'un ADN cible jusqu'à ce qu'un nombre suffisant de copies soit obtenu pour la visualisation ou la quantification. En multipliant la cible analytique par un facteur de 107 à 109, les quelques molécules d'ADN d'allergène obtenues peuvent être suffisantes pour détecter avec succès les ingrédients allergènes. Initialement développée comme méthode qualitative, la PCR a ensuite été modifiée pour devenir un outil d'analyse quantitative par l'application de différents colorants ou sondes fluorescents. Le fait que la PCR détecte la molécule d'ADN extrêmement stable peut constituer un avantage lors de l'analyse d'aliments hautement transformés. L'ADN a tendance à ne pas être affecté, même par des conditions extrêmes, et peut donc être détecté même lorsque la plupart des protéines ont déjà été dégradées ou modifiées d'une manière ou d'une autre. En outre, la PCR peut être utilisée pour des allergènes tels que le céleri, qui ne peuvent pas être détectés par les anticorps. Le céleri doit être étiqueté dans l'UE, mais jusqu'à présent, toutes les tentatives de production d'anticorps fiables ont échoué en raison de la relation étroite entre le céleri et d'autres plantes comme le persil, la carotte, la coriandre ou le fenouil. Au cours de la dernière décennie, de nouvelles techniques de détection de l'ADN ont été mises au point. Toutes ces méthodes dites d'amplification isotherme sont d'une certaine manière liées à la PCR conventionnelle, mais peuvent être réalisées presque sans aucun instrument. Un simple bloc chauffant est utilisé pour amplifier l'ADN cible et la détection visuelle ultérieure est réalisée à l'aide de colorants fluorescents. L'amplification isotherme est généralement plus rapide que la PCR, moins sujette aux impuretés co-isolées et, dans de nombreux cas, encore plus sensible.
Publié le :
Allergènes alimentaires
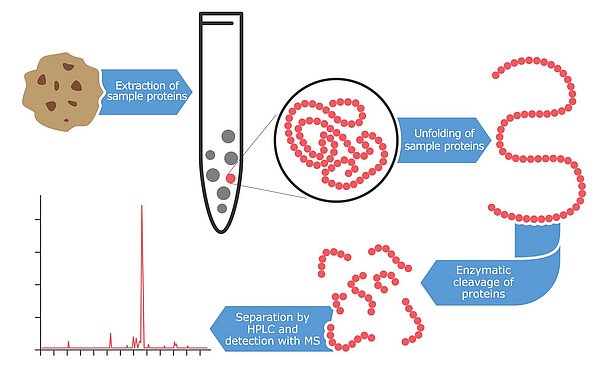
La spectrométrie de masse : une technologie de pointe
Une technologie encore plus récente pour détecter et quantifier les allergènes est la spectrométrie de masse, une méthode de haute technologie qui identifie les protéines et les peptides avec un très haut niveau de précision. Les premières tentatives d'application de cette technologie à la détection des allergènes ont débuté à la fin des années 1990, mais la plupart des résultats n'ont été publiés qu'au cours des dernières années. Le principal avantage de l'utilisation de cette technologie pour la détection des allergènes est le niveau élevé de confiance et de fiabilité. Les instruments ont la capacité de détecter plusieurs peptides par protéine. Idéalement, deux à trois peptides fragmentaires sont analysés par allergène. L'avantage de cette approche est que même si les protéines sont partiellement dégradées ou modifiées en raison des conditions difficiles de transformation des aliments, la probabilité de trouver au moins un fragment intact est assez élevée. Ces peptides marqueurs sont sélectionnés dans des bases de données ou dans la littérature et doivent être hautement spécifiques des allergènes à quantifier. En outre, ils sont choisis pour être résistants aux altérations dues à la transformation des aliments. Cette stratégie de reconnaissance multipeptidique de l'allergène n'est pas possible avec les tests immunologiques. Les anticorps se lient généralement à un seul fragment particulier (immunogène) de l'allergène. Si ce petit fragment est modifié, la reconnaissance de la cible peut être entravée. En outre, la spectrométrie de masse est capable de mesurer plusieurs allergènes en parallèle. Ces méthodes multi-analytes sont devenues particulièrement populaires ces dernières années. Cette stratégie innovante permet de rechercher de nombreux allergènes dans une seule extraction d'échantillon et en un seul cycle d'analyse. La procédure d'extraction pour l'analyse par spectrométrie de masse est plus laborieuse que pour les autres approches. Tout d'abord, l'échantillon est mélangé à un tampon d'extraction contenant souvent du dithiothréitol ou de l'urée pour créer un environnement réducteur qui rompt les liaisons disulfures des protéines. Le résidu de l'échantillon est ensuite éliminé par centrifugation et les protéines linéarisées sont clivées à l'aide d'enzymes de digestion. Quelques heures ou une nuit sont nécessaires pour couper les protéines allergènes en petits fragments peptidiques à l'aide de ces enzymes. Bien que les étapes préparatoires prennent du temps, la solution peptidique résultante peut ensuite être analysée pour plusieurs allergènes en parallèle à l'aide d'un spectromètre de masse. Les méthodes multiples actuelles peuvent quantifier jusqu'à sept allergènes en parallèle, mais on peut s'attendre à ce que ce nombre augmente considérablement au cours des prochaines années. Les méthodes multi-analytes pour les mycotoxines ont commencé avec quelques analytes il y a seulement une dizaine d'années et aujourd'hui, les conceptions d'essai les plus avancées sont capables d'analyser plus de 400 toxines en parallèle.

Pourquoi les techniques d'ADN peuvent-elles échouer ?
Bien que la détection de l'ADN des composés alimentaires allergènes puisse présenter certains avantages par rapport aux méthodes immunologiques, cette approche présente de graves inconvénients. L'ADN étant l'analyte de choix pour la PCR, il est difficile/impossible de faire la distinction entre l'œuf ou le lait et l'ADN du tissu correspondant de la poule ou de la vache, dont l'ADN est identique. Certains échantillons, comme le blanc d'œuf ou le lait, ne contiennent que de faibles quantités d'ADN mais beaucoup de protéines allergènes ; cette méthode n'est donc pas adaptée à l'analyse de ces types d'échantillons.
La meilleure méthode ?
La spectrométrie de masse peut probablement être considérée comme la méthode d'analyse des allergènes présentant le plus grand potentiel d'améliorations futures en raison de sa fiabilité, de sa sensibilité et de la possibilité d'effectuer des analyses multi-allergènes.
Cependant, il n'y a pas d'approche sans inconvénients. La spectrométrie de masse nécessite un personnel hautement qualifié et les coûts d'investissement initiaux sont élevés en raison du coût élevé de l'instrumentation. En outre, le délai d'obtention des résultats sera toujours beaucoup plus long que pour les méthodes immunologiques.
Pas de méthode unique
La méthode parfaite, l'étalon-or pour la quantification des allergènes, n'existe pas. ELISA et LFD sont les méthodes de choix pour la majorité des applications industrielles. Les résultats peuvent être obtenus relativement rapidement, les coûts sont modérés ou faibles et le personnel peut être facilement formé à l'utilisation de ces tests. Pour certains problèmes tels que le matériel d'essai hautement traité ou des analytes spécifiques, la PCR peut donner de meilleurs résultats. La spectrométrie de masse se situe à l'extrémité supérieure des technologies disponibles, mais n'en est encore qu'à ses débuts pour les tests d'allergènes. Toutefois, ces dernières années, elle est devenue la méthode de choix pour de nombreux autres défis analytiques. On peut s'attendre à ce que cette technologie connaisse un essor dans le domaine de l'analyse des allergènes dans un avenir proche.