Retour à la bibliothèque Romer
Tests sur les OGM : 4 questions importantes
Publié le :
OGM

Testez-vous des protéines ou de l'ADN ? En quoi les méthodes d'analyse des matières premières diffèrent-elles de celles des matières transformées ? Ce ne sont là que deux considérations que toute personne souhaitant tester les OGM doit garder à l'esprit. Christina Huber, chef de produit, apporte des réponses pratiques.
Comme nous l'avons vu dans l'article précédent, les réglementations relatives à l'autorisation de commercialiser ou de cultiver des plantes génétiquement modifiées sur le territoire national varient d'un pays à l'autre. Par conséquent, les critères d'essai varient considérablement d'un pays à l'autre. Cet article présente quelques considérations de base pour choisir le bon format de test afin de déterminer si un échantillon est dérivé d'une plante génétiquement modifiée. La modification génétique désigne toute altération artificielle de l'ADN d'une plante, soit en modifiant le génome, soit en insérant des fragments d'ADN étrangers. Le gène modifié transmettra une nouvelle caractéristique, telle que la résistance aux insectes, la résistance aux herbicides ou d'autres caractéristiques importantes pour l'agriculture. L'une des premières questions que vous vous poserez sera de savoir si vous souhaitez tester l'ADN ou les protéines. En complément de cette décision, vous devez déterminer si c'est la matière première ou la matière transformée qui sera testée. Une troisième question concerne votre objectif : recherchez-vous un caractère OGM spécifique ou voulez-vous simplement savoir si votre culture est exempte d'OGM ? Enfin, des facteurs tels que la sensibilité, la rapidité et la facilité d'utilisation jouent également un rôle important. Toutes ces décisions vous aideront à choisir le format adéquat parmi les options de test les plus courantes : réaction en chaîne de la polymérase (PCR), dosage immuno-enzymatique (ELISA) ou dispositifs à flux latéral (LFD).
1) ADN ou protéine ?
La modification de la plante entraîne une modification de sa séquence d'ADN. L'altération peut être déterminée en identifiant la modification artificielle de l'ADN lui-même ou en détectant la protéine exprimée, qui n'existe pas à l'état naturel dans la culture en question. Les méthodes d'analyse basées sur les acides nucléiques, comme la PCR, amplifient une région intéressante du génome de la plante pour obtenir des milliards de copies de petits fragments d'ADN à l'aide d'amorces et de l'ADN polymérase en tant qu'enzyme. Auparavant, ces fragments d'ADN pouvaient être séparés et visualisés sur un gel d'agarose, mais aujourd'hui, des instruments plus sophistiqués permettent de mesurer directement la réaction d'amplification grâce à des techniques de fluorescence. L'approche PCR n'est pas seulement qualitative, elle permet également de quantifier le matériel génétique dans un échantillon. Pour la détection des protéines, on utilise des tests immunologiques. Ces tests immunologiques utilisent des anticorps spécifiques qui peuvent se lier à la protéine. Deux formats de test sont disponibles : le dispositif à flux latéral (LFD) et le test immuno-enzymatique (ELISA). Les deux systèmes fonctionnent en sandwich, c'est-à-dire qu'un anticorps est immobilisé sur une surface qui lie spécifiquement la protéine en question. Une fois que la protéine s'est liée à l'anticorps immobilisé, un anticorps secondaire marqué peut se lier, formant ainsi un sandwich et produisant un signal coloré. Si la protéine d'intérêt n'est pas disponible, aucun sandwich ne peut se former et aucune couleur n'est donc visible, ce qui indique que la plante testée est exempte d'OGM. Dans la plupart des cas, l'ELISA utilise une plaque à 96 puits recouverte de l'anticorps spécifique qui permet l'analyse simultanée de plusieurs échantillons. Les LFD sont des bandelettes comportant une ligne de test et une ligne de contrôle recouvertes de l'anticorps spécifique qui capture la protéine en question. Si la ligne de test apparaît, le résultat est positif, indiquant la présence de la protéine cible. Ces tests existent dans un format quantitatif ou qualitatif ; un lecteur LFD est nécessaire pour quantifier le résultat. En résumé, les tests ADN lisent la séquence d'ADN modifiée, tandis que les tests protéiques identifient la nouvelle protéine dérivée de cette séquence d'ADN spécifique. Les qualités spécifiques de l'échantillon à analyser jouent également un rôle dans la détermination de la méthode basée sur l'ADN ou sur les protéines qui répond le mieux à vos besoins. Nous allons maintenant examiner les différentes exigences en matière d'analyse des matières premières et des matériaux transformés.
2) En quoi l'analyse des matières premières diffère-t-elle de celle des matières transformées ?
Lorsqu'il s'agit de déterminer la technique d'essai appropriée, une autre question se pose, au-delà de la cible (ADN ou protéine) : la matrice est-elle constituée de matières premières ou de matières transformées ? Cette question est particulièrement pertinente pour l'analyse des protéines. Les matières premières expriment la protéine intacte, ce qui signifie que les tests PCR et immunologiques peuvent être utilisés. Cependant, une fois qu'une matière première a été transformée, ses protéines se dénaturent, ce qui modifie leur structure naturelle et, dans la plupart des cas, ne peut être détecté par les tests immunologiques. Le traitement thermique, par exemple, est un processus qui peut entraîner la dénaturation des protéines. Toutefois, ce processus ne modifie pas la séquence d'ADN ; par conséquent, la PCR peut être utilisée pour détecter le gène inséré, même dans certains matériaux transformés. Si votre échantillon est un produit brut, vous disposez d'un plus grand nombre d'options de test : les approches basées sur l'ADN et sur les protéines détecteront toutes deux la modification génétique. En revanche, si votre échantillon est un matériau fortement transformé dans lequel la protéine peut avoir été dénaturée, les possibilités sont limitées à l'analyse de l'ADN.
3) Mon échantillon présente-t-il un caractère spécifique ? Est-il exempt d'OGM ? Qu'avez-vous besoin de savoir exactement ?
Il est parfois nécessaire de tester un échantillon pour des caractéristiques spécifiques afin de déterminer s'il contient des plantes interdites dans certaines régions. Il peut également être nécessaire de déterminer si l'échantillon est totalement exempt d'OGM, indépendamment de toute caractéristique particulière. Pour tester la présence d'un OGM spécifique, il est important de savoir quelles protéines sont exprimées dans l'OGM en question. Cette information peut être obtenue auprès du producteur ou de sources telles que la page web de l'ISAAA (http://www.isaaa.org/), où tous les OGM approuvés sont répertoriés. L'étape suivante consiste à déterminer le format de test souhaité (PCR, ELISA ou LFD) en fonction de la spécificité souhaitée, du temps nécessaire à l'obtention du résultat, du type de matériel et de l'équipement de laboratoire disponible. Les analystes doivent être prudents, car de nombreux produits OGM ne contiennent pas qu'un seul gène inséré, mais plusieurs (appelés "stacked events") ; par conséquent, si vous voulez tester un OGM spécifique, vous devez tester tous les gènes insérés (ou les protéines exprimées) associés à cette plante particulière. Une autre stratégie d'analyse des OGM consiste à déterminer si la plante contient du matériel génétiquement modifié. Ce type de test n'est pas spécifique à un événement particulier. Pour déterminer si un échantillon est totalement exempt d'OGM, il suffit de ne tester qu'un seul événement pour chaque culture ; cette méthode est efficace même pour les cultures d'OGM présentant des événements superposés, car il suffit de prouver la présence d'un seul événement pour prouver la présence d'un OGM. Les trois techniques sont appropriées pour ce type de test. La PCR fournit la gamme la plus large, car, par exemple, le terminal NOS ou le promoteur 35S sont très souvent insérés. Dans le cas d'un test avec des bandelettes LFD, une bandelette combinée permet de détecter plusieurs protéines à la fois. Ces deux approches dépendent uniquement des besoins du client, car pour certains, il peut être plus important de savoir si la culture est exempte d'OGM (comme dans un pays où la culture est interdite, mais où des plantations illégales peuvent avoir lieu). D'autres voudront savoir précisément quelle plante ils ont plantée.
4) Comment choisir la bonne méthode d'essai en tenant compte d'autres facteurs tels que l'environnement de l'essai ?
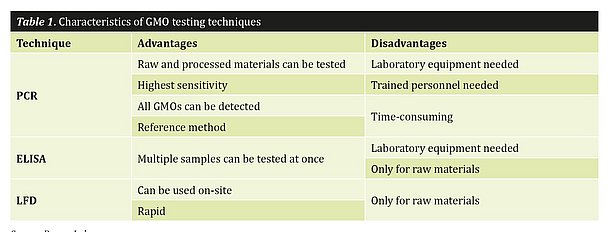
L'environnement d'essai est un autre facteur qui joue un rôle dans le choix du format d'essai approprié. Disposerez-vous d'un laboratoire et d'un personnel qualifié ou préférez-vous un test rapide ne nécessitant pas d'équipement de laboratoire ? Le tableau 1 résume les formats de test disponibles ainsi que leurs avantages et inconvénients. Examinons ce tableau étape par étape. En tant que méthode de référence pour les tests d'OGM, la PCR est la méthode la plus appropriée si vous souhaitez tester n'importe quel matériel transformé. Cette technique offre également le degré de sensibilité le plus élevé et permet de détecter pratiquement tous les OGM. Toutefois, elle présente un inconvénient de taille : elle nécessite un équipement de laboratoire et un personnel qualifié. Pour effectuer une PCR, en particulier lorsqu'une quantification est souhaitée, il est essentiel de savoir pipeter avec précision, car un pipetage imprécis peut conduire à des résultats erronés ou non concluants. Le principal avantage d'un test ELISA est la possibilité de tester plusieurs échantillons simultanément. C'est important lorsque vous souhaitez effectuer des tests sur une seule graine. Toutefois, comme il s'agit d'un test basé sur les protéines, il ne peut être utilisé que pour les matières premières. Si vous comparez les trois techniques en termes de délai d'obtention des résultats, la méthode LFD est la plus rapide. Les bandelettes LFD peuvent être utilisées sur place et ne nécessitent pas d'instrumentation sophistiquée. Par conséquent, si vous souhaitez tester une cargaison entrante et que vous avez besoin de résultats rapides, il serait très raisonnable d'opter pour un test LFD, car les résultats sont disponibles en 10 minutes ; aucun personnel de laboratoire et peu d'équipement ne sont nécessaires. Cette technique ne nécessite pas non plus de compétences en laboratoire, car la procédure est conçue pour être facile à utiliser. Quelle est donc la méthode la plus efficace ? Votre décision dépend en fin de compte du temps que vous souhaitez consacrer à l'obtention des résultats et des installations, de l'équipement et du personnel dont vous disposez.
Publié le :
OGM
Conclusion : la valeur des solutions personnalisées pour les essais d'OGM
Dans l'ensemble, vous devez tenir compte de plusieurs facteurs pour trouver la bonne stratégie d'essai. Cela dépend du matériel que vous souhaitez tester (brut ou transformé), de la rapidité des résultats, de votre capacité à mettre en place un laboratoire avec du matériel et du personnel, et de votre souhait de savoir spécifiquement quel trait OGM vous avez ou si vous voulez savoir si votre culture est exempte d'OGM. Il n'y a pas de bonne ou de meilleure technique, car votre décision dépend de votre réponse à toutes ces questions. Certains opteront pour les LFD afin de respecter des délais serrés, tandis que d'autres souhaiteront obtenir des résultats plus spécifiques et plus détaillés à l'aide de la PCR. D'autres encore, comme les instituts de recherche, peuvent vouloir tester leur champ de recherche et d'essai et effectuer des tests sur une seule graine de plusieurs échantillons à l'aide de la technique ELISA. La prise en compte de tous ces éléments vous aidera à faire le bon choix au moment de tester votre culture.