Retour à la bibliothèque Romer
Cytométrie en flux par impédance et son utilisation dans la surveillance des environnements de transformation des aliments
Publié le :
Microbiologie
Qu'est-ce que la cytométrie en flux ?
La cytométrie de flux désigne un groupe de techniques qui utilisent un laser ou un champ électrique pour compter les cellules en suspension dans un liquide et déterminer certaines de leurs propriétés physiques ou chimiques. Dans le meilleur des cas, une seule cellule à la fois traverse le canal microfluidique du cytomètre, qui détecte les variations de la longueur d'onde de la lumière ou de la charge électrique lors du passage de chaque cellule ou d'autres particules. Comme la cytométrie de flux nécessite généralement des appareils volumineux et coûteux ainsi que des étapes préparatoires fastidieuses, la méthode a traditionnellement été limitée à une utilisation en laboratoire dans des domaines d'application tels que la recherche et la médecine.
Publié le :
Microbiologie

Déployer la cytométrie de flux par impédance pour compter à la fois les cellules et les particules de résidus
La cytométrie de flux par impédance est dérivée de la technologie qui sous-tend les compteurs de particules Coulter, qui peuvent dimensionner et compter les particules en suspension dans des électrolytes en se basant sur les changements d'impédance provoqués par le déplacement des électrolytes par les particules. En mesurant plusieurs fréquences en même temps pour chaque particule qui passe, la cytométrie de flux par impédance permet de distinguer les particules en fonction non seulement de leur taille, mais aussi de leurs propriétés électriques. Il s'agit d'une variante puissante de la cytométrie en flux, car elle est très robuste et peut être utilisée pour évaluer des caractéristiques cellulaires impossibles à mesurer sans l'utilisation de marqueurs moléculaires, comme l'intégrité de la membrane cellulaire. Par conséquent, au lieu d'un laser, un cytomètre de flux à impédance utilise un courant alternatif dont les fréquences variables permettent à l'appareil de détecter, de mesurer la taille et de compter séparément les cellules en contact avec la membrane et d'autres particules. Par rapport à d'autres appareils de cytométrie de flux, les cytomètres de flux à impédance peuvent être légers, portables et alimentés par une batterie, ce qui permet de les utiliser là où l'échantillon est prélevé.

Comment les cytomètres de flux à impédance font-ils la différence entre les cellules et les autres particules ?
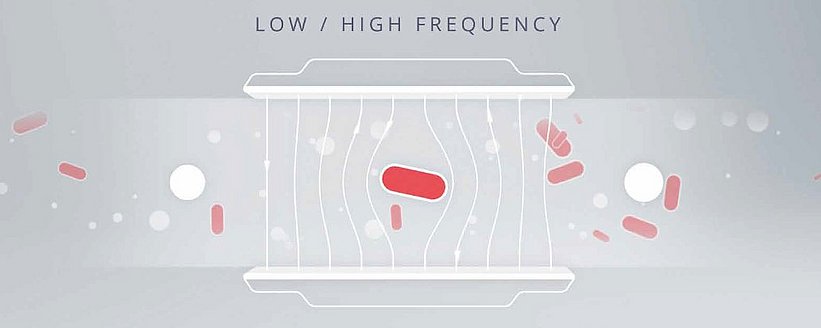
La cytométrie de flux par impédance tire parti des propriétés électromagnétiques uniques de la membrane cellulaire et du cytoplasme pour distinguer les bactéries des autres particules. La membrane et le cytoplasme d'une cellule influencent le champ électrique d'une manière différente des autres particules de l'échantillon. Un exemple utilisant des particules métalliques (conductrices), des particules non conductrices et des cellules intactes permet d'illustrer ce principe de la manière la plus claire. Quelle que soit la fréquence du champ électrique, la conductivité des particules métalliques permet au champ électrique de passer sans entrave. À l'inverse, les particules non conductrices telles que le polystyrène résisteront au champ électrique ; le courant n'avancera que dans le milieu liquide, ce qui entraîne un déplacement de volume mesurable en corrélation avec les particules dans le canal d'écoulement. Les cellules intactes, cependant, sont uniques en ce sens qu'elles ressemblent à la fois à des particules non conductrices et à des particules métalliques, en fonction de la fréquence du champ électrique. À basse fréquence, la qualité isolante de la membrane d'une cellule empêche le champ électrique de la pénétrer, ce qui entraîne le même type de déplacement qu'avec des particules non conductrices. Les fréquences plus élevées, en revanche, peuvent pénétrer partiellement la membrane ; la conductivité des cellules est donc similaire à celle des particules métalliques. Les microélectrodes des cytomètres de flux à impédance génèrent des champs à la fois à basse et à haute fréquence, ce qui permet à l'appareil de détecter ces changements de conductivité et de résistance et de les attribuer en nombre précis à des cellules intactes ou à d'autres particules. Le détecteur identifie la cible comme étant une bactérie sur la base du degré variable d'impédance ou de conductivité à ces fréquences. L'utilisateur reçoit alors un décompte séparé des cellules intactes et des autres particules.

Comment la cytométrie en flux par impédance se compare-t-elle aux méthodes culturales ?
Les méthodes culturales, en particulier l'utilisation de plaques d'agar, constituent l'approche traditionnelle du contrôle de l'assainissement des environnements de transformation des aliments. Cependant, les méthodes culturales, bien que bien établies, présentent plusieurs inconvénients en termes de rapidité et de portée. Les méthodes culturales sont lentes : il faut entre un et dix jours pour que les bactéries se développent en colonies dénombrables. Ces méthodes ne mesurent que ce qui est cultivable dans les conditions spécifiques d'un essai donné ; une espèce ou un autre groupe de bactéries peut nécessiter une gélose ou un milieu liquide spécifique à une température, un degré de lumière ou d'humidité précis, pour ne citer que quelques variables. Les méthodes culturales ne peuvent pas non plus prétendre à une mesure complète de toutes les bactéries présentes dans un échantillon. L'"anomalie du grand nombre de plaques", une énigme bien connue en microbiologie, observe que seule une petite fraction des bactéries d'un habitat peut être récupérée par la culture. Les bactéries viables mais non cultivables (VBNC) sont vivantes mais, en raison du stress, d'idiosyncrasies ou de facteurs environnementaux non optimaux, elles ne peuvent pas se développer sur gélose ou en milieu liquide. Dans certains cas, il est possible de les cultiver après réanimation, un processus qui, là encore, prend du temps. Certaines bactéries pathogènes, comme E. coli O157, sont connues pour entrer dans un état de VBNC pour ensuite proliférer à des stades ultérieurs de la chaîne alimentaire ou chez des hôtes humains après ingestion.En outre, les bactéries anaérobies et microaérophiles nécessitent l'absence d'oxygène ou des niveaux d'oxygène inférieurs à ceux des conditions atmosphériques normales, respectivement. Les bactéries de ces groupes qui sont cultivables nécessitent des conditions d'incubation spéciales, ce qui augmente le coût des tests analytiques. Les cytomètres de flux à impédance comptent toutes les bactéries qui passent dans le canal d'écoulement, quel que soit leur état (cultivable, VBNC, non cultivable, dormant) ou leurs exigences de croissance. Cette quantification directe et immédiate élargit le champ d'application d'un programme de contrôle de l'hygiène ; les bactéries qui ne se multiplient pas avant d'entrer en contact avec des aliments ou des hôtes potentiels peuvent également être ciblées à l'aide de la cytométrie de flux par impédance. Elle permet également de prendre des mesures immédiates lorsque le nettoyage et la désinfection ne se déroulent pas comme prévu.