Retour à la bibliothèque Romer
Plus petit, c'est mieux : Améliorer les résultats des analyses de mycotoxines en réduisant la taille des particules
Publié le :
Mycotoxine

Les dernières recherches montrent que la taille des particules dans un échantillon a un effet considérable sur la précision des méthodes d'analyse des mycotoxines. Henriette Hobbs et Nora Kogelnik, expertes en mycotoxines, analysent le problème et proposent quelques recommandations pour que vos opérations d'analyse des mycotoxines restent précises et fiables.
Publié le :
Mycotoxine
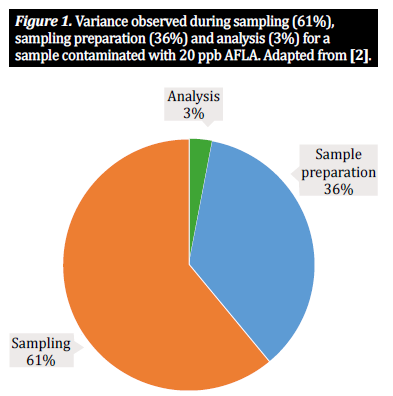
Dans la communauté analytique des mycotoxines, nous travaillons généralement avec trois étapes procédurales principales lorsqu'il s'agit de produits agricoles tels que le maïs, le blé et l'orge : l'échantillonnage, la préparation de l'échantillon et l'analyse. Pour déterminer la concentration de mycotoxines présente dans un lot en vrac, nous devons analyser une partie plus petite mais toujours représentative du lot ; cela signifie qu'il est impossible d'obtenir des résultats fiables sans un plan d'échantillonnage adéquat, qui comprend le prélèvement d'échantillons progressifs du lot et leur combinaison en un sous-échantillon (également connu sous le nom d'échantillon en vrac). Cela permet de s'assurer que l'échantillon à tester est réellement représentatif du lot. À partir de là, nous nous concentrons sur la préparation de l'échantillon. Pour les produits à base de céréales, la préparation de l'échantillon consiste en deux étapes importantes : le broyage de l'échantillon et le sous-échantillonnage : 1) un moulin ou un autre dispositif est utilisé pour broyer les grains de l'échantillon en vrac afin de réduire la taille des particules et d'assurer l'uniformité ; 2) à partir de cet échantillon, nous obtenons un sous-échantillon représentatif de l'ensemble du lot, que nous testons ensuite. Cet échantillon est ensuite préparé pour l'extraction selon un protocole défini [10]. Cependant, l'échantillonnage et la préparation des échantillons sont des processus complexes, pleins d'embûches potentielles ; chaque étape du processus de préparation des échantillons introduit un niveau de variabilité qui contribue à la variabilité totale d'un seul résultat d'analyse [2, 5]. De nombreuses études ont montré que les deux tiers de la variabilité observée résultent de la méthode d'échantillonnage, un tiers étant imputable à la façon dont l'échantillon est préparé. Un pourcentage beaucoup plus faible de la variabilité est lié à la méthode d'analyse appliquée (figure 1). La précision des résultats dépend donc du degré de prise en compte de ces trois facteurs. Alors que de nombreuses études traitent de l'importance des méthodes d'échantillonnage et des solvants analytiques sur l'effet de la détection des mycotoxines (voir [1, 2, 4] pour des exemples marquants), cet article se penchera sur l'importance de la préparation de l'échantillon, c'est-à-dire le broyage et la taille de l'échantillon, et, en résumant les recherches récentes sur le sujet, examinera l'effet de la préparation de l'échantillon sur la précision de l'analyse des mycotoxines et sur la variance de l'échantillon [10].
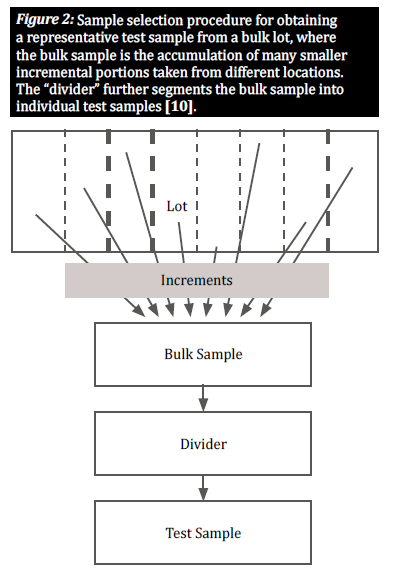
Sélectionnez un échantillon représentatif
Lorsqu'un produit est naturellement contaminé par des mycotoxines, les grains contaminés sont généralement répartis de manière inégale dans un certain lot ; ces regroupements de grains contaminés sont appelés "points chauds". Pour donner une idée précise du degré de contamination d'un lot, un plan d'échantillonnage doit tenir compte de la distribution aléatoire de ces points chauds. Pour ce faire, il faut prélever un grand nombre de petits échantillons progressifs à différents endroits du lot afin d'obtenir un échantillon représentatif (figure 2) [8]. La sélection d'échantillons progressifs dans un lot en vrac est cruciale pour donner à tous les grains une chance égale d'être sélectionnés, réduisant ainsi les biais [10].
Moudre pour garantir une taille de particule uniforme
Les moisissures qui produisent des mycotoxines ont plusieurs voies de contamination différentes ; par conséquent, les mycotoxines peuvent se trouver aussi bien à l'intérieur des grains qu'à leur surface. La voie de contamination dépend de la mycotoxine et du grain en question. Il est bien connu que certains champignons producteurs de mycotoxines, comme Fusarium, sont présents à l'intérieur du grain ou de l'amande alors que d'autres, comme Aspergillus, sont présents à la surface. Le broyage uniforme d'un échantillon résout ce problème en brisant les grains contaminés et en permettant une distribution uniforme des particules. En fin de compte, cela améliore la détection des particules contaminées [3].
Homogénéiser la distribution des mycotoxines potentielles en passant le grain à travers une grille et en le mélangeant
Après avoir sélectionné l'échantillon représentatif du lot et l'avoir broyé pour garantir une taille de particule uniforme, l'échantillon doit être homogénéisé en le mélangeant soigneusement, ce qui contribue également à le rendre représentatif de l'échantillon en vrac [3]. Les grains se séparent en fonction de leur taille, ce qui réduit le degré de représentativité de l'échantillon et conduit à un résultat d'analyse inexact. C'est pourquoi, avant le mélange, nous confirmons que l'uniformité de la mouture est adéquate en passant l'échantillon broyé à travers une maille ou un tamis. L'objectif n'est pas de filtrer les particules les plus grosses, car elles peuvent également contenir des mycotoxines ; au contraire, ces particules plus grosses doivent être incluses dans l'échantillon. Nous nous assurons plutôt de l'uniformité du broyage en vérifiant qu'un certain pourcentage de particules peut passer à travers. L'USDA-FGIS, par exemple, a établi des spécifications pour la taille de l'échantillon, le broyage de l'échantillon et le sous-échantillonnage pour l'aflatoxine, le déoxynivalénol, la fumonisine, l'ochratoxine et la zéaralénone [9]. L'USDA-FGIS recommande de broyer un échantillon de manière à ce que 60 à 75 % des particules passent au travers d'un tamis n° 20 et d'utiliser 50 g d'échantillon (y compris les particules qui ne passent pas au travers du tamis) pour l'extraction de la mycotoxine.
Veillez à ce que la taille des grains soit petite, la taille de l'échantillon grande et les résultats concernant les mycotoxines précis.
Nous utilisons les termes "exactitude" et "précision" tout au long de cet article, aussi une définition rapide de ces termes s'impose-t-elle ici : l'exactitude et la précision signifient les incertitudes associées à l'analyse qui peuvent être introduites à partir de la méthode ou du plan initial de préparation de l'échantillon. L'exactitude est définie comme la proximité d'une valeur mesurée par rapport à la valeur réelle, tandis que la précision est définie comme la proximité des valeurs mesurées les unes par rapport aux autres. L'objectif final devrait être de mettre en œuvre un processus garantissant à la fois une grande exactitude et une grande précision [10]. Des études montrent que la précision d'une méthode de détection des mycotoxines et donc la variance des résultats dépendent fortement de la taille des particules présentes dans l'échantillon. Pour démontrer la variabilité de la mesure associée à la taille des particules dans l'échantillon et à la taille de l'échantillon analysé, nous nous référons à plusieurs études qui l'ont évaluée (figure 3 et figure 4). Dans la première étude réalisée par Whitaker et al. (figure 3), des échantillons de maïs naturellement contaminés par l'aflatoxine ont été caractérisés. Les échantillons de grains de tailles différentes ont ensuite été passés au travers d'un tamis n°20 : 1) un broyage grossier (60% des particules sont passées), 2) un broyage fin (99% des particules sont passées) et 3) un broyage en poudre (avec un broyeur à marteaux). Huit échantillons de chaque intervalle de broyage ont ensuite été analysés à l'aide d'une méthode de référence HPLC modifiée afin de démontrer la variance inter-échantillons au sein d'un même état de broyage [9].
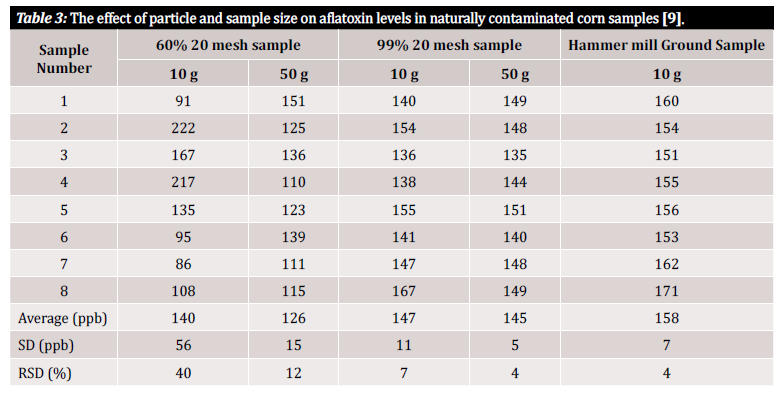
Comme vous pouvez le voir dans le tableau 3, les résultats analytiques varient en fonction de la taille de l'échantillon et de la taille du broyage. Mais comment pouvons-nous quantifier cette variation d'une manière qui nous soit utile ? L'écart-type relatif (RSD) ou le coefficient de variation (CV) sont souvent utilisés pour déterminer le degré de dissemblance des résultats dans un ensemble de données particulier. L'écart-type relatif est souvent exprimé en pourcentage et est défini par le rapport entre l'écart-type et la moyenne. Plus l'écart-type est faible, moins il y a de variations au sein de l'ensemble de données et plus le résultat est fiable. Dans les données de l'étude présentées dans le tableau 3, une variabilité significative a été observée entre les échantillons de 10 g constitués de particules de tailles différentes. Les 10 g d'échantillons grossièrement broyés présentent à 40 % la RSD la plus élevée par rapport à l'échantillon plus finement broyé (99 % d'échantillons à 20 mailles), avec une RSD calculée de 7 %. Le RSD le plus bas, 4 %, a été atteint avec les échantillons en poudre provenant du broyeur à marteaux. Bien qu'un broyeur à marteaux ne soit généralement pas financièrement réalisable pour le testeur moyen, l'étude de Whitaker et al. démontre que la meilleure façon d'éviter la variance due à la préparation de l'échantillon est de broyer finement et d'utiliser une maille pour garantir l'uniformité de la taille des particules [9].
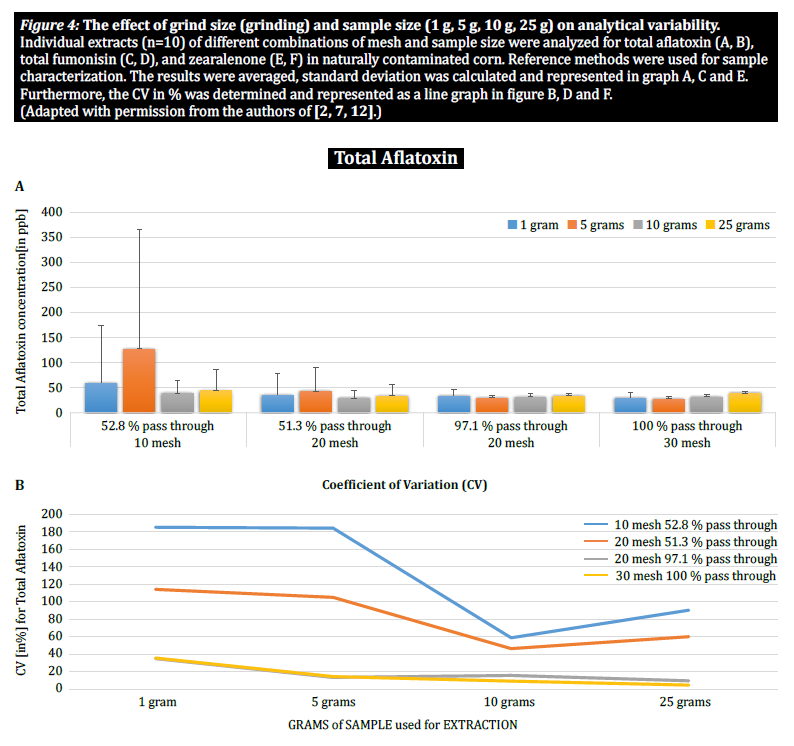
Pour mieux démontrer l'impact de la taille des particules (broyage) et de la taille de l'échantillon sur la variabilité analytique des différentes mycotoxines, Brunkhorst et al. ont effectué une analyse sur des échantillons de maïs naturellement contaminés par l'aflatoxine totale (somme des B1, B2, G1 et G2), la fumonisine totale (somme des B1, B2 et B3) ou la zéarélénone (figure 4). Pour cette étude, 10 échantillons de maïs pour chaque mycotoxine ont été broyés à différentes tailles de particules pour leur permettre de passer à travers un tamis no. 10, un tamis no. 20 ou un tamis no. 30. La variance des différentes tailles d'échantillons (1 g, 5 g, 10 g et 25 g) pour l'extraction a également été étudiée. Les échantillons d'aflatoxines ont été extraits avec de l'acétonitrile/eau (84/16) et analysés à l'aide d'une méthode AOAC et d'une cellule KOBRA pour la bromation post-colonne. Les échantillons de fumonisine ont été extraits avec du méthanol/eau (3/1) et analysés selon la méthode de l'AOAC. Les échantillons de zéaralénone ont également été extraits avec de l'acétonitrile/eau et analysés par LC-MS/MS. Note : Les données présentées dans chaque paire de graphiques sont quelque peu redondantes. Cependant, nous trouvons utile de représenter le coefficient de variation dans un graphique séparé. Les résultats montrent clairement que la taille du broyage et la taille de l'échantillon ont un impact sur la précision de l'analyse. L'étude suggère que AFLA et ZON présentent un degré de dépendance plus élevé (c'est-à-dire un CV plus élevé) par rapport au volume de l'échantillon et à la taille du broyage que FUM, bien que nous hésitions à tirer une conclusion ferme de ces études individuelles ; d'autres recherches sont nécessaires pour confirmer notre observation. La variabilité observée pour un échantillon de 10 g de maïs contaminé par l'AFLA est passée de 58,9 % (grossièrement moulu) à 9,3 % (finement moulu), pour le FUM de 39,8 % (grossièrement moulu) à 4,6 % (finement moulu), et pour le ZON de 21 % (grossièrement moulu) à 2 % (finement moulu). Ces résultats confirment l'effet de la taille de la mouture sur la variance et la précision analytiques en ce qui concerne l'extraction et l'analyse des mycotoxines des grains.
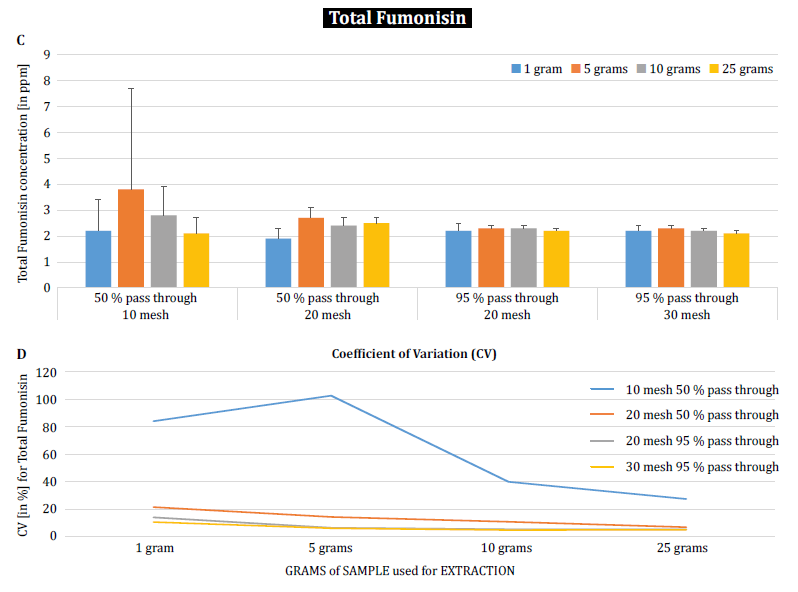
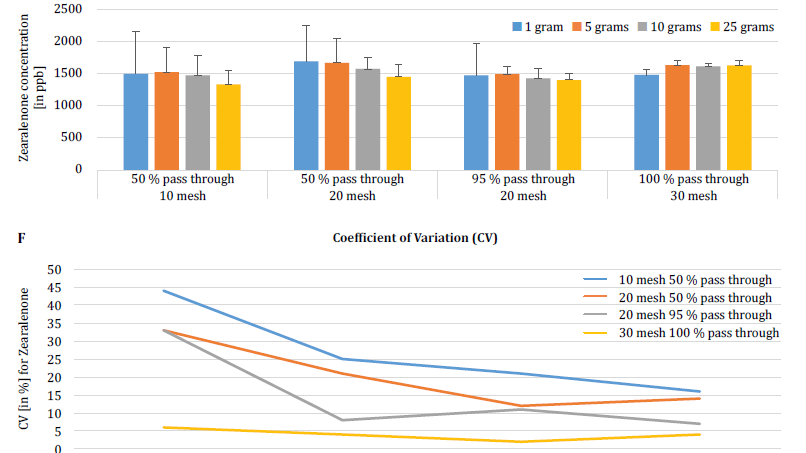
Enfin, Brunkhorst et al. ont approfondi leurs conclusions et déterminé les niveaux de déoxynivalénol dans des échantillons d'orge naturellement contaminés avec le même schéma d'étude. Les échantillons d'orge ont été broyés à quatre mailles différentes, extraits (10 extraits individuels pour chaque maille et chaque taille d'échantillon) à l'aide d'acétonitrile/eau (84/16) et analysés par LC-MS-MS (figure 5) [6]. Les résultats démontrent clairement que la variabilité analytique peut être réduite lorsque les échantillons sont broyés pour passer à travers une maille plus fine. En outre, l'augmentation de la taille de l'échantillon permet de réduire davantage la variabilité analytique. Le coefficient de variation a pu être réduit de 11 % à seulement 5 % en utilisant un échantillon de 10 g avec une maille no. 10. Une taille d'échantillon de 10 g et 25 g en combinaison avec une maille n° 20 (95 %) et n° 30 (95 %) permet d'obtenir des résultats précis et fiables. 30 (95 %) permet d'obtenir des résultats exacts et précis, réduisant le CV à 5 % et 3 %, respectivement. Comme cette étude a utilisé de l'orge au lieu du maïs, elle suggère que l'effet de la taille de l'échantillon et du broyage sur la variabilité analytique des mycotoxines n'est peut-être pas dépendant de la matrice. D'autres études sont nécessaires pour confirmer cette hypothèse [6].
Conclusion : Maillez, mélangez, répétez si nécessaire
L'importance du broyage et de la taille des échantillons, ainsi que l'impact de ces facteurs sur la réduction de la variabilité et la minimisation des erreurs lors de l'analyse des mycotoxines, sont évidents. Dans les études présentées, des variations significatives ont été observées entre les échantillons grossièrement et finement broyés provenant de la même source et du même niveau de contamination. Au-delà de la simple observation de la variation, les données de ces études suggèrent quelques approches initiales de la taille de l'échantillon et du broyage. En ce qui concerne la taille de l'échantillon, 10 g se sont avérés suffisants, tandis que 25 g peuvent fournir une précision encore plus grande. Lorsque vous utilisez une maille n° 20, 95 % de l'échantillon doit passer au travers. Avec une maille no. 30, 100 % de l'échantillon doit passer au travers. Le principal objectif de l'analyse des mycotoxines est d'obtenir des résultats précis et fiables malgré les difficultés d'échantillonnage et la complexité de la préparation des échantillons de céréales et de cultures. Cependant, même la meilleure technologie, qu'il s'agisse de tests rapides de pointe ou d'équipements de spectrométrie de masse très précis, ne sera d'aucune utilité si votre échantillon n'est pas représentatif du lot examiné. Un échantillon représentatif ne se résume pas à l'échantillonnage ; la préparation de l'échantillon est essentielle. Si vous respectez les trois facteurs clés de la préparation de l'échantillon (taille de la mouture, taille de l'échantillon et homogénéité), vous pouvez maintenir votre RSD à moins de 10 %, ce qui augmente la fiabilité de vos résultats d'analyse.