Menor é melhor: Melhore os resultados da análise de micotoxinas reduzindo o tamanho das partículas
Publicado em:
Micotoxina
Este artigo foi publicado na Spot On #13
Está curioso para ver o que o Spot On tem para oferecer?
Leia agora
A investigação mais recente mostra que o tamanho das partículas numa amostra tem um efeito considerável na precisão dos métodos analíticos de micotoxinas. As especialistas em micotoxinas Henriette Hobbs e Nora Kogelnik avaliam o problema e oferecem algumas recomendações para manter as suas operações de análise de micotoxinas precisas e fiáveis.
Publicado em:
Micotoxina
Este artigo foi publicado na Spot On #13
Está curioso para ver o que o Spot On tem para oferecer?
Leia agora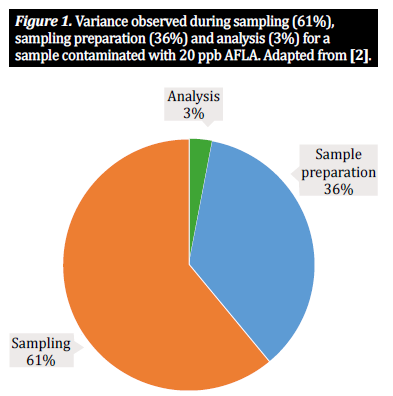
Na comunidade analítica de micotoxinas, geralmente trabalhamos com três etapas principais de procedimentos quando se trata de commodities agrícolas como milho, trigo e cevada: amostragem, preparação de amostras e análise. Para determinar a concentração de micotoxinas presente num lote a granel, temos de analisar uma porção mais pequena mas ainda assim representativa do lote; isto significa que é impossível obter resultados fiáveis sem um plano de amostragem adequado, que inclua a recolha de amostras incrementais do lote e a sua combinação numa subamostra (também conhecida como amostra a granel). Isto forma uma base que garante que a amostra a ser testada é verdadeiramente representativa do lote. A partir daqui, o nosso foco passa para a preparação da amostra. Para produtos à base de grãos, a preparação da amostra consiste em duas etapas importantes: moagem da amostra e subamostragem: 1) um moinho ou outro dispositivo é utilizado para moer o grão na amostra a granel para reduzir o tamanho das partículas e garantir a uniformidade; 2) a partir desta amostra, obtemos uma subamostra representativa de todo o lote, que é então testada. Esta amostra de teste é subsequentemente preparada para extração de acordo com um protocolo definido [10]. No entanto, a amostragem e a preparação da amostra são processos complexos, repletos de potenciais armadilhas; cada etapa do processo de preparação da amostra introduz um nível de variabilidade que contribui para a variabilidade total de um único resultado analítico [2, 5]. Numerosos estudos demonstraram que dois terços da variabilidade observada resultam do método de amostragem, sendo um terço atribuível à forma como a amostra é preparada. Uma percentagem muito menor de variabilidade está relacionada com o método analítico aplicado (figura 1). Por conseguinte, a exatidão dos resultados depende do grau de consideração destes três factores. Embora numerosos estudos discutam a importância dos métodos de amostragem e dos solventes analíticos no efeito da deteção de micotoxinas (ver [1, 2, 4] para exemplos proeminentes), este artigo considerará a importância da preparação da amostra, ou seja, trituração e tamanho da amostra, e, ao resumir pesquisas recentes sobre o assunto, discutirá o efeito que a preparação da amostra tem na análise precisa de micotoxinas e na variação da amostra [10].
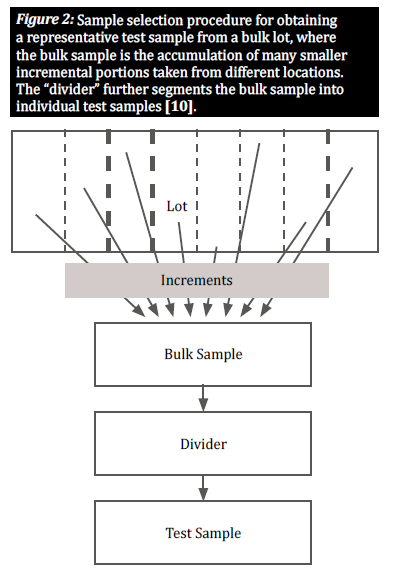
Seleccione uma amostra representativa
Quando um produto está naturalmente contaminado com micotoxinas, os grãos contaminados estão geralmente distribuídos de forma desigual num determinado lote; estes agrupamentos de grãos contaminados são conhecidos como "pontos quentes". Para obter uma visão exacta do grau de contaminação de um lote, um plano de amostragem deve ter em conta a distribuição aleatória desses pontos quentes. Para tal, é necessário recolher um grande número de pequenas amostras elementares em vários locais distribuídos pelo lote, de modo a obter uma amostra representativa (figura 2) [8]. A seleção de amostras incrementais de um lote a granel é crucial para dar a todos os grãos uma oportunidade igual de serem seleccionados, reduzindo assim o enviesamento [10].
Moa para garantir um tamanho de partícula uniforme
Os bolores que produzem micotoxinas têm várias vias diferentes de contaminação; como resultado, as micotoxinas podem ser encontradas tanto no interior dos grãos como na sua superfície. A via de infeção depende da micotoxina e do grão em questão. Sabe-se que certos fungos produtores de micotoxinas, como o Fusarium, estão presentes no interior do grão ou da amêndoa, enquanto outros, como o Aspergillus, estão presentes na superfície. A moagem uniforme de uma amostra resolve este problema, quebrando os grãos contaminados e permitindo uma distribuição uniforme das partículas. Isto acaba por melhorar a deteção de partículas contaminadas [3].
Homogeneizar a distribuição potencial de micotoxinas passando o grão por uma malha e misturando
Depois de selecionar a amostra representativa do lote e de a moer para garantir uma granulometria uniforme, a amostra deve ser homogeneizada, misturando-a cuidadosamente; isto também ajuda a torná-la representativa da amostra global [3]. Os grãos segregam-se de acordo com o tamanho, reduzindo o grau de representatividade da amostra e conduzindo a um resultado analítico incorreto. Por esta razão, antes da mistura, confirmamos que a uniformidade da moagem é adequada, passando a amostra moída através de uma malha ou peneira. O objetivo não é filtrar as partículas maiores, uma vez que estas também podem conter micotoxinas; pelo contrário, estas partículas maiores devem ser incluídas na amostra. O objetivo é garantir a uniformidade da moagem, verificando se uma determinada percentagem de partículas consegue passar. O USDA-FGIS, por exemplo, estabeleceu especificações para o tamanho da amostra, trituração da amostra e subamostragem para aflatoxina, desoxinivalenol, fumonisina, ocratoxina e zearalenona [9]. O USDA-FGIS recomenda que uma amostra seja moída de forma que 60-75% das partículas passem por uma peneira nº 20 e que 50 g de amostra de teste (incluindo as partículas que não passam pela peneira) sejam usadas para a extração da micotoxina.
Mantenha o tamanho do grão pequeno, o tamanho da amostra grande e os resultados das micotoxinas precisos
Utilizamos os termos "exatidão" e "precisão" ao longo deste artigo, pelo que se impõe uma definição rápida destes termos: exatidão e precisão significam incertezas associadas à análise que podem ser introduzidas a partir do método ou plano inicial de preparação da amostra. A exatidão é definida como a proximidade de um valor medido em relação ao valor verdadeiro, enquanto a precisão é definida como a proximidade dos valores medidos entre si. O objetivo final deve ser a implementação de um processo que garanta tanto uma elevada exatidão como uma elevada precisão [10]. Os estudos mostram que a precisão de um método de deteção de micotoxinas e, por conseguinte, a variância dos resultados dependem grandemente do tamanho das partículas na amostra. Para demonstrar a variabilidade da medição associada ao tamanho das partículas na amostra e ao tamanho da amostra em análise, referimo-nos a vários estudos que a avaliaram (figura 3 e figura 4). No primeiro estudo realizado por Whitaker et al. (apresentado na figura 3), foram caracterizadas amostras de milho naturalmente contaminadas por aflatoxina. As amostras de grãos de diferentes tamanhos foram posteriormente passadas por uma peneira nº 20: 1) uma moagem grosseira (60% das partículas passaram), 2) uma moagem fina (99% das partículas passaram) e 3) em pó (com um moinho de martelos). Oito amostras de cada intervalo de moagem foram então analisadas usando um método de referência HPLC modificado para demonstrar a variação entre amostras dentro de um único estado de moagem [9].
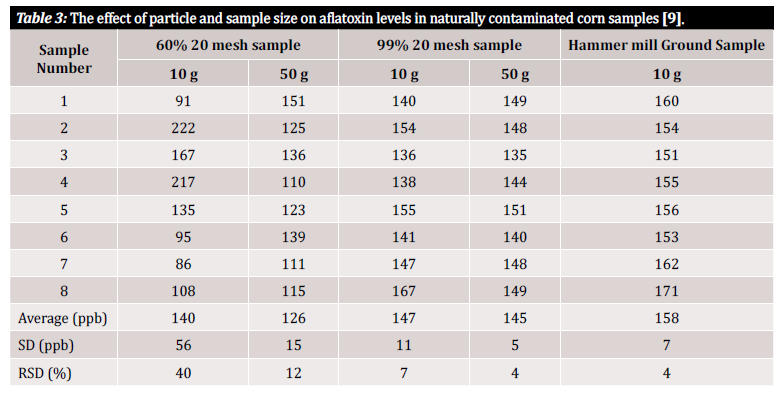
Como pode ver na tabela 3, existe uma variação nos resultados analíticos dependendo do tamanho da amostra e do tamanho do grão. No entanto, como é que podemos quantificar esta variação de uma forma que nos seja útil? O desvio padrão relativo (RSD) ou o coeficiente de variação (CV) são frequentemente utilizados para determinar a diferença entre os resultados de um determinado conjunto de dados. O RSD é frequentemente declarado como uma percentagem e é definido pelo rácio entre o desvio padrão e a média. Quanto mais baixo for o desvio padrão, menor é a variação dentro do conjunto de dados e mais fiável é o resultado. Nos dados do estudo apresentados no quadro 3, observou-se uma variabilidade significativa entre amostras de 10 g constituídas por partículas de diferentes dimensões. As amostras de 10 g moídas grosseiramente apresentam 40% do RSD mais elevado quando comparadas com a amostra moída mais finamente (99% amostra de 20 malhas), com um RSD calculado de 7%. O RSD mais baixo, 4%, foi atingido com as amostras em pó do moinho de martelos. Embora um moinho de martelos possa não ser financeiramente viável para o testador médio, o estudo de Whitaker et al. demonstra que a melhor maneira de evitar a variação proveniente da preparação da amostra é moer finamente e usar uma malha para garantir a uniformidade do tamanho das partículas [9].
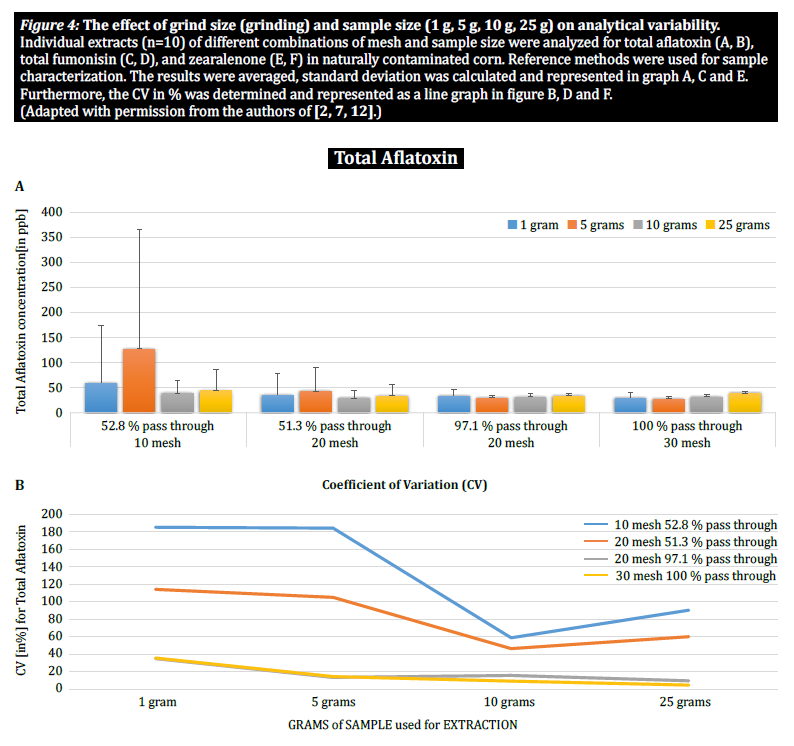
Para demonstrar ainda mais o impacto do tamanho da partícula (trituração) e do tamanho da amostra na variabilidade analítica entre diferentes micotoxinas, Brunkhorst et al. efectuaram uma análise em amostras de milho naturalmente contaminadas com aflatoxina total (soma de B1, B2, G1 e G2), fumonisina total (soma de B1, B2 e B3) ou zearelenona (figura 4). Para este estudo, 10 amostras de milho para cada micotoxina foram moídas em diferentes tamanhos de partículas para permitir que passassem através de uma peneira no. 10, um peneiro n.º 20 ou um peneiro n.º 30. 30. A variância de diferentes tamanhos de amostras (1 g, 5 g, 10 g e 25 g) para extração foi também investigada. As amostras de aflatoxina foram extraídas com acetonitrilo/água (84/16) e analisadas utilizando um método AOAC e uma célula KOBRA para bromação pós-coluna. As amostras de fumonisina foram extraídas com metanol/água (3/1) e também analisadas de acordo com o método da AOAC. As amostras de zearealenona foram também extraídas com acetonitrilo/água e analisadas por LC-MS/MS. Nota: Os dados apresentados em cada par de gráficos são um pouco redundantes. No entanto, consideramos útil representar o coeficiente de variação num gráfico separado. Os resultados mostram claramente que o tamanho da trituração e o tamanho da amostra têm impacto na exatidão da análise. O estudo sugere que o AFLA e o ZON apresentam um maior grau de dependência (ou seja, um CV mais elevado) do volume da amostra e do tamanho da moagem do que o FUM, embora hesitemos em tirar uma conclusão firme destes estudos individuais; é necessária mais investigação para confirmar a nossa observação. Para tamanhos de amostra de 1 g e 5 g, os RSDs para AFLA, FUM e ZON foram mais elevados em comparação com tamanhos de amostra de 10 g e 25 g. A variabilidade observada para uma amostra de 10 g de milho contaminado com AFLA diminuiu de 58,9% (moído grosseiramente) para 9,3% (moído finamente), para FUM de 39,8% (moído grosseiramente) para 4,6% (moído finamente), e para ZON de 21% (moído grosseiramente) para 2% (moído finamente). Estes resultados confirmam ainda mais o efeito do tamanho da moagem na variação e precisão analíticas no que diz respeito à extração e análise de micotoxinas de grãos.
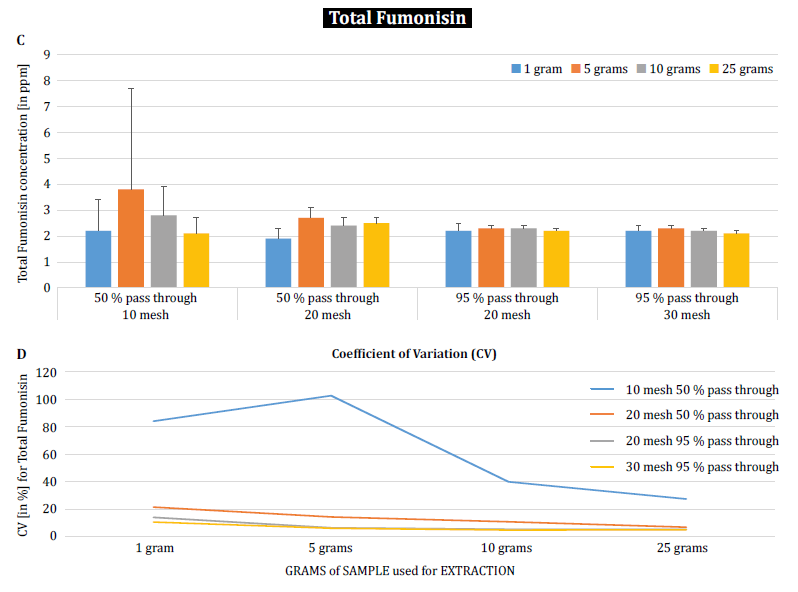
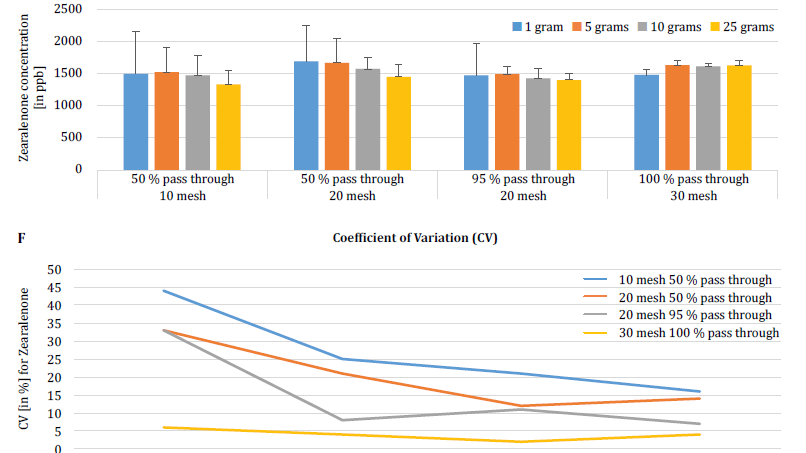
Por fim, Brunkhorst et al. elucidaram ainda mais as suas descobertas e determinaram os níveis de desoxinivalenol em amostras de cevada naturalmente contaminadas com o mesmo esquema de estudo. As amostras de cevada foram moídas em quatro malhas diferentes, extraídas (10 extractos individuais em cada malha e tamanho de amostra) utilizando acetonitrilo/água (84/16) e analisadas por LC-MS-MS (figura 5) [6]. Os resultados demonstram claramente que a variabilidade analítica pode ser reduzida quando as amostras são trituradas para passar por uma malha mais fina. Além disso, o aumento do tamanho da amostra ajuda ainda mais a reduzir a variabilidade analítica. O coeficiente de variação pôde ser reduzido de 11% para apenas 5% quando se utilizou uma amostra de 10 g com uma malha n. 10. Um tamanho de amostra de 10 g e 25 g em combinação com uma malha n.º 20 (95%) e n.º 30 (95%) permite obter resultados exactos. 30 (95%) fornece resultados exactos e precisos, reduzindo o CV para 5% e 3%, respetivamente. Como este estudo utilizou cevada em vez de milho, sugere que o efeito do tamanho da amostra e da moagem na variabilidade analítica das micotoxinas pode não ser dependente da matriz. São necessários mais estudos para confirmar este facto [6].
Conclusão: Triture, misture, repita conforme necessário
A importância da trituração e do tamanho da amostra, bem como o impacto que estes factores têm na redução da variabilidade e na minimização de erros durante a análise de micotoxinas, é evidente. Nos estudos apresentados, foi observada uma variação significativa entre amostras moídas grosseiramente e finamente da mesma fonte e nível de contaminação. Para além da simples observação da variação, os dados destes estudos sugerem algumas abordagens iniciais para a dimensão e moagem da amostra. Quanto à dimensão da amostra, 10 g provaram ser suficientes, enquanto 25 g podem proporcionar uma precisão ainda maior. Se utilizar uma malha n.º 20, 95% da amostra deve passar. Se utilizar uma malha n. 30, 100% da amostra deve passar. O principal objetivo da análise de micotoxinas é obter resultados precisos e fiáveis, apesar das dificuldades de amostragem e das complexidades da preparação de amostras para cereais e culturas. No entanto, mesmo a melhor tecnologia, quer seja sob a forma de testes rápidos de ponta ou de equipamento de espetrometria de massa altamente preciso, será inútil se a sua amostra não for representativa do lote em análise. Uma amostra representativa é mais do que apenas a amostragem; a preparação da amostra é fundamental. Se respeitar os três factores-chave da preparação da amostra (tamanho do grão, tamanho da amostra e homogeneidade), pode manter o seu RSD em <10%, aumentando a fiabilidade do seu resultado analítico.