La citometria a flusso ad impedenza e il suo uso nel monitoraggio degli ambienti di lavorazione degli alimenti
Pubblicato il:
Microbiologia
Che cos'è la citometria a flusso?
La citometria a flusso si riferisce a un gruppo di tecniche che utilizzano un laser o un campo elettrico per contare le cellule sospese in un fluido e per determinare alcune delle loro proprietà fisiche o chimiche. In modo ottimale, solo una cellula alla volta passa attraverso il canale microfluidico del citometro, che rileva le variazioni della lunghezza d'onda della luce o della carica elettrica al passaggio di ogni cellula o di altre particelle. Poiché la citometria a flusso richiede in genere dispositivi grandi e costosi, nonché fasi preparatorie laboriose, il metodo è stato tradizionalmente limitato all'uso in laboratorio in campi di applicazione come la ricerca e la medicina.
Pubblicato il:
Microbiologia

Impiegare la citometria a flusso ad impedenza per contare sia le cellule che le particelle residue
La citometria a flusso ad impedenza deriva dalla tecnologia alla base dei contatori di particelle Coulter, che possono dimensionare e contare le particelle sospese negli elettroliti in base alle variazioni di impedenza causate dallo spostamento degli elettroliti da parte delle particelle. Misurando più frequenze contemporaneamente per ogni particella che passa, la citometria a flusso ad impedenza può discriminare tra le particelle in base non solo alle dimensioni, ma anche alle proprietà elettriche. Si tratta di una variante potente della citometria a flusso, in quanto è molto robusta e può essere utilizzata per valutare caratteristiche cellulari altrimenti impossibili da misurare senza l'uso di tag molecolari, come l'integrità della membrana cellulare. Pertanto, invece di un laser, un citometro a flusso ad impedenza impiega una corrente alternata, le cui frequenze variabili consentono al dispositivo di rilevare, misurare le dimensioni e contare separatamente le cellule intatte sulla membrana e altre particelle. Rispetto ad altri dispositivi citometrici a flusso, i citometri a flusso ad impedenza possono essere leggeri, portatili e alimentati a batteria, consentendo di utilizzarli dove viene prelevato il campione.

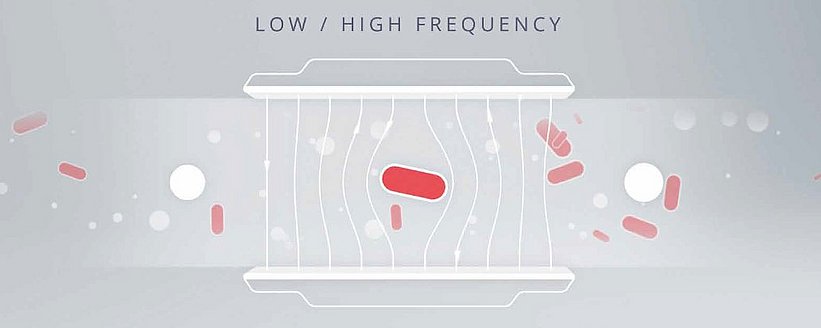
Come fanno i citometri a flusso ad impedenza a distinguere le cellule da altre particelle?
La citometria a flusso ad impedenza sfrutta le proprietà elettromagnetiche uniche della membrana cellulare e del citoplasma per distinguere i batteri da altre particelle. La membrana e il citoplasma di una cellula influenzano il campo elettrico in modo diverso dalle altre particelle presenti nel campione. Un esempio che utilizza particelle metalliche (conduttive), particelle non conduttive e cellule intatte può illustrare questo principio nel modo più chiaro. Indipendentemente dalla frequenza del campo elettrico, la conduttività delle particelle metalliche permetterà al campo elettrico di passare senza ostacoli. Al contrario, le particelle non conduttive, come il polistirene, resisteranno al campo elettrico; la corrente avanzerà solo nel mezzo liquido, il che porta a uno spostamento di volume misurabile, correlato alle particelle nel canale di flusso. Le cellule intatte, tuttavia, sono uniche in quanto assomigliano a particelle sia non conduttive che metalliche, a seconda della frequenza del campo elettrico. A basse frequenze, la qualità isolante della membrana di una cellula impedisce al campo elettrico di penetrare, portando allo stesso tipo di spostamento delle particelle non conduttive. Le frequenze più alte, invece, possono penetrare parzialmente la membrana; in quanto tali, le cellule sono simili in conduttività alle particelle metalliche. I microelettrodi nei citometri a flusso ad impedenza generano campi sia a bassa che ad alta frequenza, consentendo al dispositivo di rilevare queste variazioni di conduttività e resistenza e di attribuirle in numero preciso a cellule intatte o ad altre particelle. Il rilevatore identifica il bersaglio come batterio in base al grado variabile di impedenza o conduttività a queste frequenze. L'utente riceve quindi conteggi separati di cellule intatte e altre particelle.

Come si confronta la citometria a flusso ad impedenza con i metodi culturali?
I metodi culturali, in particolare l'uso di piastre di agar, sono l'approccio tradizionale per monitorare la sanificazione degli ambienti di lavorazione degli alimenti. Tuttavia, i metodi culturali, sebbene ben consolidati, presentano diversi svantaggi per quanto riguarda la velocità e la portata. I metodi culturali sono lenti e richiedono da uno a dieci giorni perché i batteri si sviluppino in colonie contestabili. Questi metodi misurano solo ciò che è coltivabile nelle condizioni specifiche di un determinato test; una specie o un altro gruppo di batteri può richiedere un terreno agar o liquido specifico ad una temperatura, un grado di luce o un'umidità esatti, per citare solo alcune variabili. I metodi culturali, inoltre, non possono pretendere di misurare in modo completo tutti i batteri presenti in un campione. La "grande anomalia del conteggio delle piastre", un enigma ben noto in microbiologia, osserva che solo una piccola frazione dei batteri in un habitat può essere recuperata con la coltura. I batteri in uno stato vitale ma non coltivabile (VBNC) sono vivi, ma a causa di stress, idiosincrasie o fattori ambientali non ottimali non possono crescere su agar o in mezzi liquidi. In alcuni casi, possono essere coltivati dopo la rianimazione, un processo che, ancora una volta, richiede molto tempo. Alcuni batteri patogeni, come l'E. coli O157, sono noti per entrare in uno stato VBNC, per poi proliferare in fasi successive della catena alimentare o negli ospiti umani dopo l'ingestione. Inoltre, i batteri anaerobi e microaerofili richiedono rispettivamente l'assenza di ossigeno o livelli di ossigeno inferiori a quelli delle normali condizioni atmosferiche. I batteri di questi gruppi, che sono coltivabili, richiedono condizioni di incubazione speciali, che aumentano il costo dei test analitici. I citometri a flusso a impedenza contano tutti i batteri che passano attraverso il canale di flusso, indipendentemente dal loro stato (coltivabile, VBNC, non coltivabile, dormiente) o dai requisiti di crescita. Questa quantificazione diretta e immediata amplia la portata di un programma di controllo dell'igiene; anche i batteri che non si moltiplicano fino a quando non entrano in contatto con il cibo o con potenziali ospiti possono essere presi di mira con la citometria a flusso a impedenza. Inoltre, consente di intervenire immediatamente quando la pulizia e la disinfezione non vanno secondo i piani.