Più piccolo è meglio: Migliorare i risultati dell'analisi delle micotossine riducendo le dimensioni delle particelle
Pubblicato il:
Micotossina

Le ultime ricerche dimostrano che la dimensione delle particelle in un campione ha un effetto considerevole sull'accuratezza dei metodi analitici delle micotossine. Le esperte di micotossine Henriette Hobbs e Nora Kogelnik valutano il problema e offrono alcune raccomandazioni per mantenere le operazioni di analisi delle micotossine accurate e affidabili.
Pubblicato il:
Micotossina
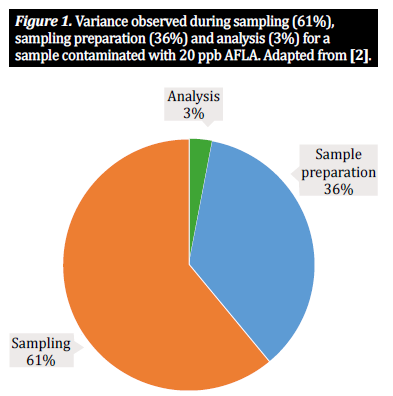
Nella comunità analitica delle micotossine, in genere lavoriamo con tre fasi procedurali principali quando si tratta di materie prime agricole come mais, grano e orzo: campionamento, preparazione del campione e analisi. Per determinare la concentrazione di micotossine presenti in un lotto sfuso, dobbiamo analizzare una porzione più piccola ma comunque rappresentativa del lotto; ciò significa che risultati affidabili sono impossibili senza un piano di campionamento adeguato, che prevede il prelievo di campioni incrementali del lotto e la loro combinazione in un sottocampione (noto anche come campione sfuso). Questo costituisce una base che garantisce che il campione da testare sia veramente rappresentativo del lotto. Da qui, la nostra attenzione si sposta sulla preparazione del campione. Per i prodotti a base di cereali, la preparazione del campione consiste in due fasi importanti, la macinazione del campione e il sottocampionamento: 1) si utilizza un mulino o un altro dispositivo per macinare i cereali nel campione sfuso, per ridurre le dimensioni delle particelle e garantire l'uniformità; 2) da questo campione, si ottiene un sottocampione rappresentativo dell'intero lotto, che poi viene analizzato. Questo campione di prova viene successivamente preparato per l'estrazione secondo un protocollo definito [10]. Tuttavia, il campionamento e la preparazione del campione sono processi complessi, pieni di potenziali insidie; ogni fase del processo di preparazione del campione introduce un livello di variabilità che contribuisce alla variabilità totale di un singolo risultato analitico [2, 5]. Numerosi studi hanno dimostrato che due terzi della variabilità osservata derivano dal metodo di campionamento, con un terzo attribuibile al modo in cui il campione viene preparato. Una percentuale molto più piccola di variabilità è legata al metodo analitico applicato (figura 1). Di conseguenza, risultati accurati dipendono dal grado di considerazione di questi tre fattori. Mentre numerosi studi discutono l'importanza dei metodi di campionamento e dei solventi analitici sull'effetto del rilevamento delle micotossine (vedere [1, 2, 4] per esempi importanti), questo articolo prenderà in considerazione l'importanza della preparazione del campione, cioè la macinazione e la dimensione del campione e, riassumendo le recenti ricerche in materia, discuterà l'effetto della preparazione del campione sull'analisi accurata delle micotossine e sulla varianza del campione [10].
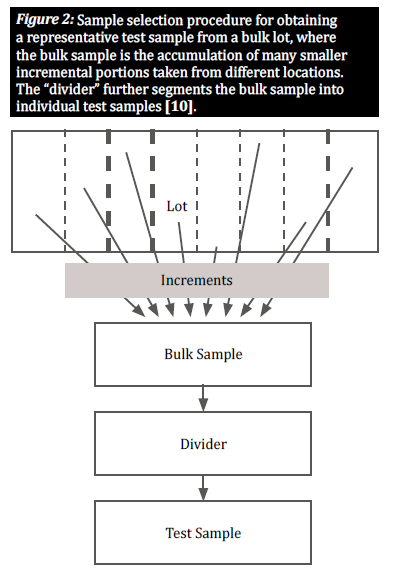
Selezionare un campione rappresentativo
Quando una merce è naturalmente contaminata da micotossine, i chicchi contaminati sono generalmente distribuiti in modo ineguale in un determinato lotto; questi raggruppamenti di chicchi contaminati sono noti come "punti caldi". Per fornire una visione accurata del grado di contaminazione di un lotto, un piano di campionamento deve tenere conto della distribuzione casuale di questi punti caldi. Ciò avviene prelevando un gran numero di piccoli campioni incrementali da varie posizioni distribuite nel lotto, al fine di ottenere un campione rappresentativo (figura 2) [8]. La selezione di campioni incrementali da un lotto di massa è fondamentale per dare a tutti i grani una possibilità uguale di essere selezionati, riducendo così i pregiudizi [10].
Macinare per garantire una dimensione uniforme delle particelle
Le muffe che producono micotossine hanno diverse vie di contaminazione; di conseguenza, le micotossine possono essere trovate sia all'interno dei grani che sulla superficie. La via di infezione dipende dalla micotossina e dal cereale in questione. È noto che alcuni funghi produttori di micotossine, come il Fusarium, sono presenti all'interno del chicco o del kernel, mentre altri, come l'Aspergillus, sono presenti sulla superficie. La macinazione uniforme di un campione risolve questo problema, rompendo i chicchi contaminati e consentendo una distribuzione uniforme delle particelle. In definitiva, questo migliora il rilevamento delle particelle contaminate [3].
Omogeneizzare la potenziale distribuzione di micotossine facendo passare la granella attraverso una rete e mescolando
Dopo aver selezionato il campione rappresentativo del lotto e averlo macinato per garantire una dimensione uniforme delle particelle, il campione deve essere omogeneizzato mescolandolo accuratamente; questo aiuta anche a renderlo rappresentativo del campione globale [3]. I grani si segregano in base alle dimensioni, riducendo il grado di rappresentatività del campione e portando a un risultato analitico impreciso. Per questo motivo, prima della miscelazione, confermiamo che l'uniformità della macinatura è adeguata facendo passare il campione macinato attraverso una rete o un setaccio. L'obiettivo non è quello di filtrare le particelle più grandi, perché potrebbero contenere micotossine; al contrario, queste particelle più grandi devono essere incluse nel campione. Piuttosto, assicuriamo l'uniformità della macinazione, verificando che una certa percentuale di particelle sia in grado di passare. L'USDA-FGIS, ad esempio, ha stabilito delle specifiche per la dimensione del campione, la macinazione del campione e il sottocampionamento per aflatossina, deossinivalenolo, fumonisina, ocratossina e zearalenone [9]. L'USDA-FGIS raccomanda di macinare un campione in modo che il 60-75% delle particelle passi attraverso un setaccio n. 20 e di utilizzare 50 g di campione di prova (comprese le particelle che non passano attraverso il setaccio) per l'estrazione della micotossina.
Mantenga la dimensione dei grani piccola, la dimensione del campione grande e i risultati delle micotossine accurati.
In questo articolo utilizziamo i termini "accuratezza" e "precisione", per cui è necessaria una rapida definizione di questi termini: l'accuratezza e la precisione indicano le incertezze associate all'analisi che possono essere introdotte dal metodo o dal piano di preparazione del campione iniziale. L'accuratezza è definita come la vicinanza di un valore misurato al valore vero, mentre la precisione è definita come la vicinanza dei valori misurati tra loro. L'obiettivo finale dovrebbe essere quello di implementare un processo che garantisca sia un'elevata accuratezza che un'elevata precisione [10]. Gli studi dimostrano che la precisione di un metodo di rilevamento delle micotossine e quindi la varianza dei risultati dipendono molto dalle dimensioni delle particelle all'interno del campione. Per dimostrare la variabilità di misurazione associata alle dimensioni delle particelle all'interno del campione e alle dimensioni del campione in analisi, facciamo riferimento a diversi studi che l'hanno valutata (figura 3 e figura 4). Nel primo studio condotto da Whitaker et al. (mostrato nella figura 3), sono stati caratterizzati campioni di mais naturalmente contaminati da aflatossina. I campioni di grani di diverse dimensioni sono stati successivamente passati attraverso un setaccio n. 20: 1) una macinatura grossolana (il 60% delle particelle è passato attraverso), 2) una macinatura fine (il 99% delle particelle è passato attraverso) e 3) polverizzati (con un mulino a martelli). Otto campioni di ciascun intervallo di macinazione sono stati poi analizzati con un metodo di riferimento HPLC modificato per dimostrare la varianza inter-campione all'interno di un singolo stato di macinazione [9].
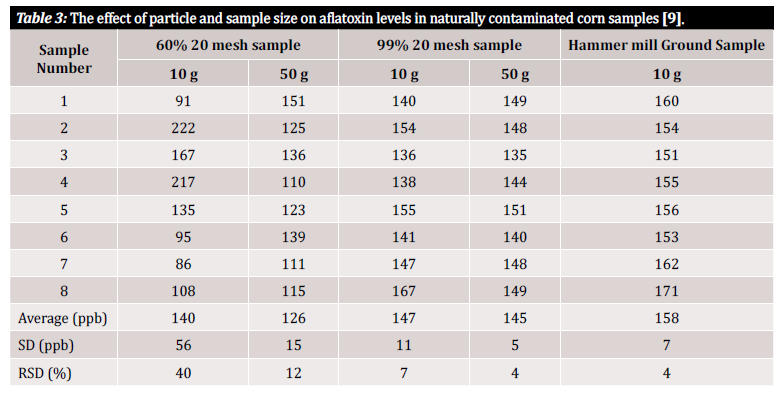
Come si può vedere nella tabella 3, c'è una variazione nei risultati analitici a seconda della dimensione del campione e della macinatura. Ma come possiamo quantificare questa variazione in modo utile per noi? La deviazione standard relativa (RSD) o il coefficiente di variazione (CV) sono spesso utilizzati per determinare quanto siano dissimili i risultati di una particolare serie di dati. La RSD è spesso dichiarata in percentuale ed è definita dal rapporto tra la deviazione standard e la media. Più bassa è la deviazione standard, minore è la variazione all'interno del set di dati e più affidabile è il risultato. Nei dati dello studio illustrati nella tabella 3, è stata osservata una significativa variabilità tra i campioni di 10 g costituiti da particelle di dimensioni diverse. I campioni da 10 g macinati grossolanamente mostrano al 40% l'RSD più alto rispetto al campione macinato più finemente (99% campione a 20 maglie), con un RSD calcolato del 7%. L'RSD più basso, pari al 4%, è stato raggiunto con i campioni in polvere del mulino a martelli. Sebbene un mulino a martelli non sia tipicamente fattibile dal punto di vista economico per il tester medio, lo studio di Whitaker et al. dimostra che il modo migliore per evitare la varianza derivante dalla preparazione del campione è macinare finemente e utilizzare una maglia per garantire l'uniformità delle dimensioni delle particelle [9].
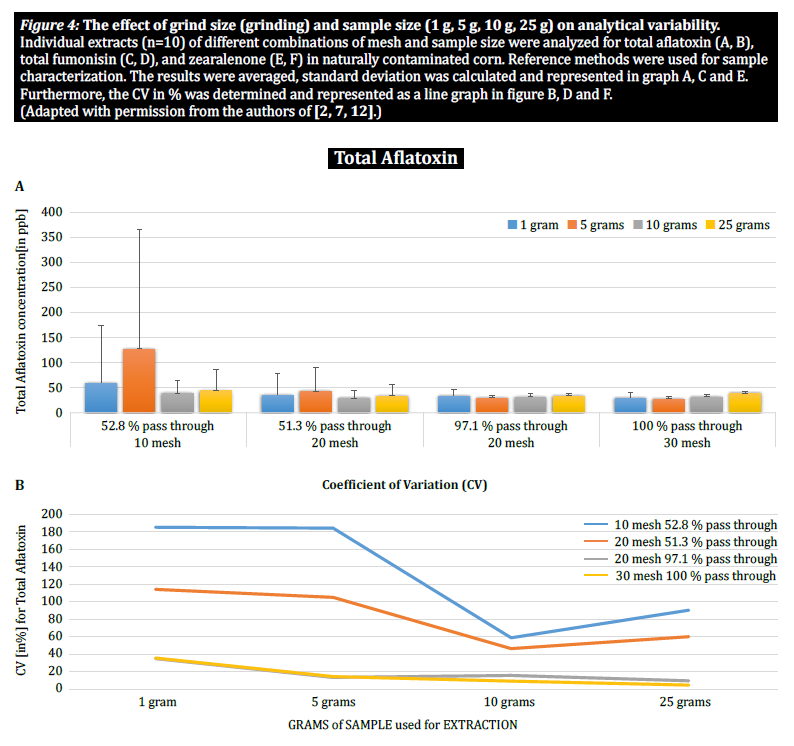
Per dimostrare ulteriormente l'impatto della dimensione delle particelle (macinazione) e del campione sulla variabilità analitica tra le diverse micotossine, Brunkhorst et al. hanno eseguito un'analisi su campioni di mais naturalmente contaminati da aflatossina totale (somma di B1, B2, G1 e G2), fumonisina totale (somma di B1, B2 e B3) o zearelenone (figura 4). Per questo studio, 10 campioni di mais per ciascuna micotossina sono stati macinati a diverse dimensioni di particelle per consentire il passaggio attraverso un setaccio no. 10, un setaccio no. 20 o un setaccio no. 30. È stata inoltre studiata la varianza delle diverse dimensioni dei campioni (1 g, 5 g, 10 g e 25 g) per l'estrazione. I campioni di aflatossina sono stati estratti con acetonitrile/acqua (84/16) e analizzati con un metodo AOAC e una cella KOBRA per la bromurazione postcolonna. I campioni di fumonisina sono stati estratti con metanolo/acqua (3/1) e analizzati secondo il metodo AOAC. Anche i campioni di zearealenone sono stati estratti con acetonitrile/acqua e analizzati con LC-MS/MS. Nota: i dati mostrati in ogni coppia di grafici sono in qualche modo ridondanti. Tuttavia, riteniamo utile rappresentare il coefficiente di variazione in un grafico separato. I risultati mostrano chiaramente che la dimensione del macinato e del campione influiscono sull'accuratezza dell'analisi. Lo studio suggerisce che AFLA e ZON presentano un grado di dipendenza maggiore (cioè un CV più alto) dal volume del campione e dalla dimensione della macinatura rispetto al FUM, anche se esitiamo a trarre una conclusione definitiva da questi singoli studi; sono necessarie ulteriori ricerche per confermare la nostra osservazione. Per le dimensioni del campione di 1 g e 5 g, le RSD per AFLA, FUM e ZON erano più alte rispetto alle dimensioni del campione di 10 g e 25 g. La variabilità osservata per un campione di 10 g di mais contaminato da AFLA è diminuita dal 58,9% (macinato grossolanamente) al 9,3% (macinato finemente), per FUM dal 39,8% (macinato grossolanamente) al 4,6% (macinato finemente) e per ZON dal 21% (macinato grossolanamente) al 2% (macinato finemente). Questi risultati affermano ulteriormente l'effetto della macinatura sulla varianza e l'accuratezza analitica per quanto riguarda l'estrazione e l'analisi delle micotossine dai cereali.
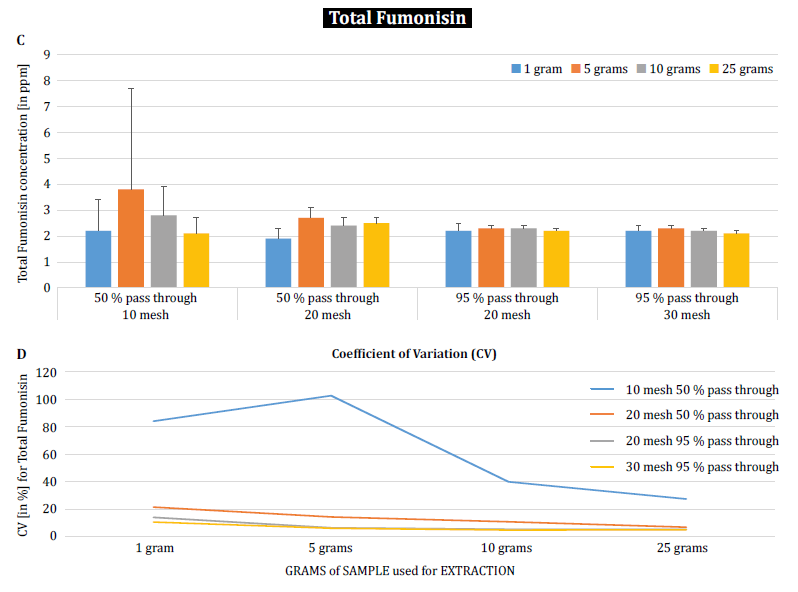
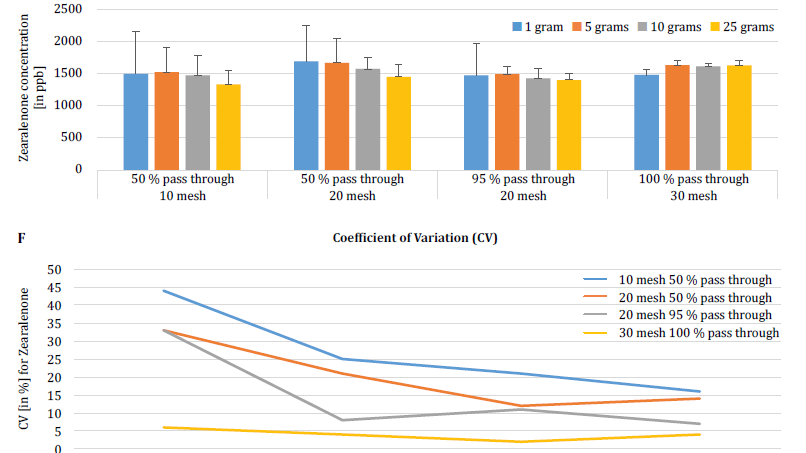
Infine, Brunkhorst et al. hanno ulteriormente chiarito le loro scoperte e determinato i livelli di deossinivalenolo in campioni di orzo naturalmente contaminati con lo stesso schema di studio. I campioni di orzo sono stati macinati in quattro diverse dimensioni di maglia, estratti (10 estratti individuali per ogni maglia e dimensione del campione) utilizzando acetonitrile/acqua (84/16) e analizzati mediante LC-MS-MS (figura 5) [6]. I risultati dimostrano chiaramente che la variabilità analitica può essere ridotta quando i campioni vengono macinati per passare attraverso una maglia più fine. Inoltre, l'aumento delle dimensioni del campione contribuisce ulteriormente a ridurre la variabilità analitica. Il coefficiente di variazione è stato ridotto dall'11% ad appena il 5% quando si è utilizzato un campione da 10 g con una maglia no. 10 mesh. Una dimensione del campione di 10 g e 25 g in combinazione con una maglia no. 20 (95%) e no. 30 (95%) fornisce risultati accurati e precisi, riducendo il CV al 5% e al 3%, rispettivamente. Poiché questo studio ha utilizzato l'orzo invece del mais, suggerisce che l'effetto della dimensione del campione e della macinazione sulla variabilità analitica delle micotossine potrebbe non essere dipendente dalla matrice. Sono necessari ulteriori studi per confermarlo [6].
Conclusione: Macinare, mescolare, ripetere se necessario
L'importanza della macinazione e della dimensione del campione, nonché l'impatto di questi fattori sulla riduzione della variabilità e sulla minimizzazione degli errori durante l'analisi delle micotossine, è evidente. Negli studi presentati, è stata osservata una variazione significativa tra campioni macinati grossolanamente e finemente, provenienti dalla stessa fonte e dallo stesso livello di contaminazione. Al di là della semplice osservazione della variazione, i dati di questi studi suggeriscono alcuni approcci iniziali alla dimensione del campione e alla macinazione. Per quanto riguarda le dimensioni del campione, 10 g si sono dimostrati sufficienti, mentre 25 g possono fornire una precisione ancora maggiore. Quando si utilizza una maglia n. 20, dovrebbe passare il 95% del campione. Quando si utilizza una maglia no. 30, il 100% dovrebbe passare. L'obiettivo principale dell'analisi delle micotossine è ottenere risultati accurati e affidabili, nonostante le difficoltà di campionamento e la complessità della preparazione dei campioni di cereali e colture. Tuttavia, anche la migliore tecnologia, che sia sotto forma di test rapidi all'avanguardia o di apparecchiature di spettrometria di massa altamente precise, non servirà a nulla se il campione non è rappresentativo del lotto in esame. Per un campione rappresentativo non basta solo il campionamento; la preparazione del campione è fondamentale. Se si attiene ai tre fattori chiave della preparazione del campione (dimensione della macinazione, dimensione del campione e omogeneità), può mantenere l'RSD a <10%, aumentando l'affidabilità del risultato analitico.