Poza testami immunologicznymi na alergeny
Opublikowano:
Alergeny pokarmowe
Ten artykuł został opublikowany w Spot On #2
Są Państwo ciekawi, co Spot On ma do zaoferowania?
Proszę przeczytać teraz
Większość dostępnych na rynku zestawów do testowania alergenów pokarmowych opiera się na zastosowaniu metod immunologicznych, takich jak ELISA lub urządzenia przepływu bocznego (testy paskowe). Do przeprowadzenia testu ELISA wymagany jest przeszkolony personel, ale wiele próbek może być analizowanych równolegle przy użyciu 48-dołkowych lub 96-dołkowych płytek mikromiareczkowych. Ogólnie rzecz biorąc, analiza może trwać od 30 minut do kilku godzin. Obecnie test ELISA jest najczęściej stosowaną metodą wykrywania i ilościowego oznaczania alergenów pokarmowych. Jednakże, chociaż wiele próbek może być analizowanych w tym samym czasie, próbki te mogą być badane tylko pod kątem jednego analitu.
Ograniczenia, które należy wziąć pod uwagę
Ze względu na wysoką swoistość przeciwciał wobec tylko jednego konkretnego białka alergennego i ograniczeń związanych z technologią, dla każdego alergenu należy stosować oddzielny zestaw. Ponadto, wysoki stopień specyficzności dla jednego alergenu może prowadzić do wyników fałszywie ujemnych. Etapy przetwarzania żywności, takie jak obróbka cieplna, dodawanie związków kwasowych lub fermentacja mogą modyfikować strukturę docelowego białka. Te zmodyfikowane alergeny mogą utracić swoje właściwości immunologiczne, a kompleks przeciwciało-białko docelowe nie może już powstać. Prowadzi to do wyników fałszywie ujemnych lub zmniejszonych oznaczeń ilościowych. Testy paskowe są niedrogie, bardzo łatwe w użyciu, nie wymagają sprzętu laboratoryjnego i dają wyniki zwykle w ciągu kilku minut. Jednak większość testów paskowych ma charakter jakościowy i opiera się na przeciwciałach jako elementach rozpoznających. W związku z tym cierpią one na te same problemy, co testy ELISA w przypadku wysoko przetworzonej żywności. W ostatnich latach opracowano alternatywne metody analizy, aby przezwyciężyć przynajmniej niektóre ograniczenia systemów testów immunologicznych.
Wykrywanie alergenów za pomocą DNA
PCR (reakcja łańcuchowa polimerazy) jest stosunkowo szybką i niedrogą metodą identyfikacji DNA. Technologia ta, opracowana w latach 80-tych XX wieku, od tego czasu jest stale udoskonalana. PCR jest stosowana od wielu lat w diagnostyce medycznej, kryminalistyce, monitorowaniu środowiska i kwantyfikacji genetycznie zmodyfikowanych organizmów w żywności i paszach. Na początku XXI wieku po raz pierwszy zastosowano PCR do identyfikacji DNA powszechnych alergenów pokarmowych, takich jak orzechy laskowe i orzeszki ziemne. Do tej pory opublikowano testy PCR dla większości "wielkiej ósemki" w USA i 14 alergenów pokarmowych w UE. PCR amplifikuje małe fragmenty docelowego DNA, aż do uzyskania wystarczającej liczby kopii do wizualizacji lub kwantyfikacji. Mnożąc cel analityczny przez współczynnik 107 do 109, kilka uzyskanych cząsteczek DNA alergenu może być wystarczające do skutecznego wykrycia składników alergennych. Początkowo opracowana jako metoda jakościowa, PCR została później zmodyfikowana, aby stać się narzędziem do analizy ilościowej poprzez zastosowanie różnych fluorescencyjnych barwników lub sond. Fakt, że PCR wykrywa niezwykle stabilną cząsteczkę DNA może być zaletą podczas analizy wysoko przetworzonej żywności. DNA ma tendencję do pozostawania nienaruszonym nawet w ekstremalnych warunkach i dlatego może być nadal wykrywane, nawet jeśli większość białek została już zdegradowana lub zmodyfikowana w jakiś sposób. Co więcej, PCR może być stosowany w przypadku alergenów, takich jak seler, których nie można wykryć za pomocą przeciwciał. Seler musi być oznakowany w UE, ale do tej pory wszystkie próby wytworzenia wiarygodnych przeciwciał nie powiodły się ze względu na bliskie pokrewieństwo selera z innymi roślinami, takimi jak pietruszka, marchew, kolendra czy koper włoski. W ciągu ostatniej dekady opracowano nowsze techniki wykrywania DNA. Wszystkie te tak zwane izotermiczne metody amplifikacji są w pewien sposób związane z konwencjonalną PCR, ale mogą być wykonywane prawie bez żadnego oprzyrządowania. Prosty blok grzewczy służy do amplifikacji docelowego DNA, a późniejsza detekcja wizualna jest realizowana za pomocą barwników fluorescencyjnych. Amplifikacja izotermiczna jest zwykle szybsza niż PCR i mniej podatna na wszelkie współizolowane zanieczyszczenia, a w wielu przypadkach nawet bardziej czuła.
Opublikowano:
Alergeny pokarmowe
Ten artykuł został opublikowany w Spot On #2
Są Państwo ciekawi, co Spot On ma do zaoferowania?
Proszę przeczytać teraz
Dlaczego techniki DNA mogą zawieść
Chociaż wykrywanie DNA alergennych związków spożywczych może mieć pewne zalety w porównaniu z metodami immunologicznymi, podejście to ma pewne poważne wady. Ponieważ DNA jest analitem wybieranym do PCR, trudne / niemożliwe jest rozróżnienie między jajkiem lub mlekiem a odpowiadającym mu DNA tkanki kurczaka lub krowy, ponieważ mają one identyczne DNA. Niektóre próbki, takie jak białko jaja lub mleko, zawierają tylko niewielkie ilości DNA, ale dużo alergennych białek, dlatego metoda ta nie jest odpowiednia do analizy tego typu próbek.
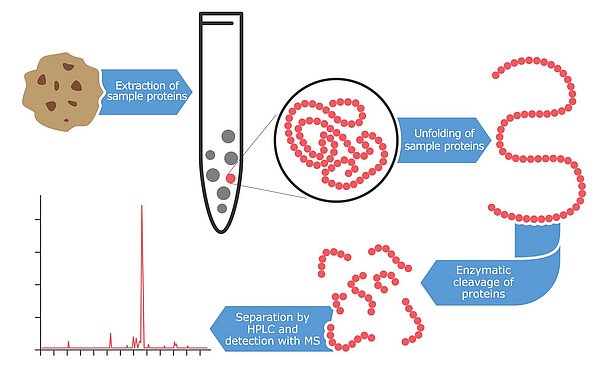
Spektrometria mas: zaawansowana technologia
Jeszcze nowszą technologią wykrywania i kwantyfikacji alergenów jest spektrometria mas, zaawansowana technologicznie metoda, która identyfikuje białka i peptydy z bardzo wysokim poziomem dokładności. Pierwsze próby zastosowania tej technologii do wykrywania alergenów rozpoczęły się pod koniec lat 90-tych, ale większość wyników została opublikowana dopiero w ciągu ostatnich kilku lat. Główną zaletą stosowania tej technologii do testowania alergenów jest wysoki poziom pewności i niezawodności. Instrumenty mają możliwość wykrywania wielu peptydów na białko. W idealnym przypadku analizowane są dwa do trzech peptydów fragmentów na alergen. Zaletą tego podejścia jest to, że nawet jeśli białka są częściowo zdegradowane lub zmodyfikowane z powodu trudnych warunków przetwarzania żywności, prawdopodobieństwo znalezienia co najmniej jednego nienaruszonego fragmentu jest dość wysokie. Te peptydy markerowe są wybierane z baz danych lub z literatury i muszą być wysoce specyficzne dla alergenów, które mają być oznaczane ilościowo. Ponadto są one wybierane tak, aby były odporne na zmiany w przetwarzaniu żywności. Ta wielopeptydowa strategia rozpoznawania alergenu nie jest możliwa w przypadku testów immunologicznych. Przeciwciała zazwyczaj wiążą się tylko z jednym konkretnym (immunogennym) fragmentem alergenu. Jeśli ten mały fragment zostanie zmodyfikowany, rozpoznanie celu może być utrudnione. Dodatkowo, spektrometria mas jest w stanie mierzyć kilka alergenów równolegle. Te metody wieloanalitowe stały się szczególnie popularne w ostatnich latach. Ta innowacyjna strategia pozwala na pojedynczą ekstrakcję próbki w celu zbadania wielu alergenów w jednym cyklu analitycznym. Procedura ekstrakcji do analizy spektrometrii mas jest bardziej pracochłonna niż w przypadku innych podejść. Najpierw próbka jest mieszana z buforem ekstrakcyjnym, często zawierającym ditiotreitol lub mocznik, aby stworzyć środowisko redukujące, które rozbija wiązania dwusiarczkowe białek. Pozostałość próbki jest następnie usuwana przez odwirowanie, a zlinearyzowane białka są rozszczepiane enzymami trawiącymi. Rozcięcie alergennych białek za pomocą tych enzymów na małe fragmenty peptydowe wymaga kilku godzin lub nocy. Chociaż etapy przygotowawcze są czasochłonne, otrzymany roztwór peptydu można następnie analizować pod kątem kilku alergenów równolegle za pomocą spektrometru mas. Obecne metody multi mogą oznaczać ilościowo do siedmiu alergenów równolegle, ale można oczekiwać, że liczba ta może znacznie wzrosnąć w ciągu najbliższych kilku lat. Metody wieloanalitowe mikotoksyn rozpoczęły się od kilku analitów zaledwie około 10 lat temu, a obecnie najbardziej zaawansowane projekty testów są w stanie analizować ponad 400 toksyn równolegle.
Najlepsza metoda?
Spektrometrię masową można prawdopodobnie uznać za metodę testowania alergenów o największym potencjale przyszłych ulepszeń ze względu na jej wyjątkową niezawodność, czułość i możliwość przeprowadzania analizy wielu alergenów.
Nie ma jednak metody bez wad. Spektrometria masowa wymaga wysoko wykwalifikowanego personelu, a początkowe koszty inwestycji są wysokie ze względu na drogie oprzyrządowanie. Ponadto czas oczekiwania na wynik zawsze będzie znacznie dłuższy niż w przypadku metod immunologicznych.
Nie ma jednego uniwersalnego rozwiązania
Nie istnieje idealna metoda, złoty standard ilościowego oznaczania alergenów. ELISA i LFD są metodami z wyboru dla większości zastosowań przemysłowych. Wyniki można uzyskać stosunkowo szybko, koszty są umiarkowane lub niskie, a personel można łatwo przeszkolić w zakresie korzystania z tych testów. W przypadku niektórych problemów, takich jak wysoce przetworzony materiał testowy lub specyficzne anality, PCR może prowadzić do lepszych wyników. Spektrometria masowa znajduje się w górnej części dostępnych technologii, ale wciąż jest w powijakach w zakresie testowania alergenów. Jednak w ostatnich latach stała się metodą z wyboru dla wielu innych wyzwań analitycznych. Można oczekiwać, że technologia ta może w niedalekiej przyszłości zyskać na popularności w dziedzinie analizy alergenów.