Jak opracować metodę LC-MS/MS opartą na wielu mikotoksynach?
Opublikowano:
Mikotoksyna
Ten artykuł został opublikowany w Spot On #5
Są Państwo ciekawi, co Spot On ma do zaoferowania?
Proszę przeczytać teraz
Często uprawy zbóż i surowce są zanieczyszczone więcej niż jedną mikotoksyną. Romer Labs opracowuje jedną metodę, która może wykrywać wiele mikotoksyn jednocześnie. Irene Hahn opisuje jak to zrobić.
Istnieje około 400 związków o niskiej masie cząsteczkowej, które są uznawane za mikotoksyny, a każdy z nich ma różne skutki toksyczne dla ludzi i zwierząt. Duża liczba możliwych zanieczyszczeń, a także powtarzające się doniesienia o współwystępowaniu mikotoksyn sprawiają, że konieczne jest opracowanie odpowiednich metod wykrywania, takich jak chromatografia cieczowa - metody spektrometrii mas (LC-MS/MS) oparte na wielu mikotoksynach, w celu jednoczesnej analizy kilku mikotoksyn. Opracowanie takich metod stanowi wyzwanie, ponieważ uwzględnienie wielu toksyn o różnych właściwościach chemicznych w jednej analizie oznacza konieczność pójścia na kompromis przy wyborze optymalnych parametrów metody.
Opublikowano:
Mikotoksyna
Ten artykuł został opublikowany w Spot On #5
Są Państwo ciekawi, co Spot On ma do zaoferowania?
Proszę przeczytać teraz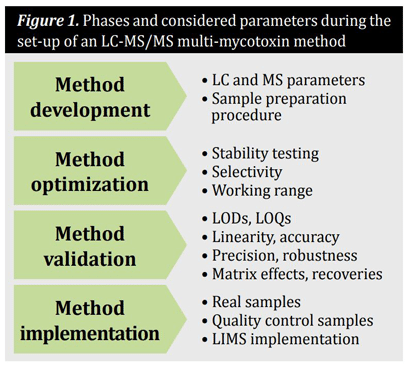
Analiza mikotoksyn w oparciu o LC-MS/MS
Metody analityczne oparte na LC w odwróconej fazie sprzężonej z MS (LC-MS/MS) stały się w ciągu ostatniej dekady potężną i najnowocześniejszą techniką w jakościowej i ilościowej analizie mikotoksyn. Zaletami tej metody są wysoka czułość i selektywność, zastosowanie do analizy wielu mikotoksyn, a także dostarczanie dodatkowych informacji na temat stosunku masy do ładunku (m/z) i jonów fragmentacyjnych badanych analitów. Obecnie istnieje silny trend w kierunku stosowania metod oznaczania wielu mikotoksyn za pomocą LC-MS/MS. Technika ta umożliwia jednoczesne oznaczanie szerokiej gamy mikotoksyn należących do różnych rodzin chemicznych w ramach jednego pomiaru. Jednak kwestie takie jak różnorodność chemiczna samych związków, szeroki zakres badanych towarów rolnych, różne zakresy stężeń i różne rozkłady występowania stanowią wyzwanie dla rozwoju i optymalizacji metod. W związku z tym należy pójść na kompromis w wyborze rozpuszczalnika ekstrakcyjnego i fazy ruchomej, a warunki mogą być dalekie od optymalnych dla niektórych analitów, które obejmują związki kwaśne (fumonizyny), zasadowe (alkaloidy sporyszu), a także polarne (moniliformina, niwalenol) i apolarne (zearalenon, beawerycyna). Ponadto brak odpowiednich dostępnych na rynku standardów analitycznych dla niektórych analitów skutkuje jedynie jakościowymi wynikami badań przesiewowych, a nie wynikami ilościowymi.
Opracowanie metody LC-MS/MS dla wielu mikotoksyn
Ogólnie rzecz biorąc, metody ilościowego oznaczania mikotoksyn w zbożach i produktach zbożowych składają się z reprezentatywnego pobierania próbek, zoptymalizowanej procedury przygotowania próbek i etapu oczyszczania, a także techniki analitycznej obejmującej separację i wykrywanie. Konfiguracja metody wielu mikotoksyn opartej na LC-MS/MS przebiega zwykle w czterech etapach. Te i rozważane parametry podsumowano na rysunku 1. Podczas opracowywania i optymalizacji metody parametry te mają znaczący wpływ na jakość i wiarygodność wyników i należy je dokładnie ocenić. W tym celu należy stosować wzorce analityczne każdego związku o określonej czystości. Jednak w przypadku niektórych analitów standardy analityczne nie są dostępne w handlu. W takich przypadkach może być możliwe uzyskanie dostępu do standardów, które są nadal w fazie badań, lub praca z dostępnym materiałem, który jest gorzej scharakteryzowany.

Opracowanie metody
Podczas opracowywania metody opartej na LC-MS/MS należy opracować parametry MS i LC, a także procedurę przygotowania próbki. W celu optymalizacji parametrów MS, każdy związek powinien być wstrzykiwany jako czysty wzorzec analityczny bezpośrednio do spektrometru mas. Następnie należy ocenić tryb idealizacji (dodatni lub ujemny), najbardziej obfite jony prekursorowe i produktowe, a także idealne potencjały odpylania, energie zderzeń i potencjały wyjścia z celi kolizyjnej. Podczas optymalizacji parametrów LC należy ocenić idealne fazy ruchome i gradient, a także optymalną kolumnę chromatograficzną. Metodą z wyboru dla procedury przygotowania próbki podczas analizy wielu mikotoksyn jest podejście "rozcieńcz i strzelaj" bez żadnego oczyszczania próbki, aby nie zafałszować wzoru mikotoksyny podczas przygotowywania próbki. Na przykład, rzadko dostępna jest metoda oczyszczania (np. ekstrakcja do fazy stałej), która nie tłumi żadnego z wymaganych analitów. Niemniej jednak, jeśli nie stosuje się oczyszczania, współwystępujące i zakłócające składniki matrycy mogą wpływać na wydajność jonizacji docelowych analitów, co skutkuje gorszą powtarzalnością i niższą dokładnością. Dlatego określenie i kompensacja takich efektów matrycy jest niezbędna. Można to osiągnąć poprzez określenie pozornego odzysku, a następnie skorygowanie wyników o tę wartość, kalibrację dopasowaną do matrycy lub zastosowanie wzorców wewnętrznych znakowanych izotopami. To ostatnie rozwiązanie pozwoli uzyskać wyniki o najwyższej dokładności i wiarygodności, przy minimalnym nakładzie czasu i kosztów.
Optymalizacja metody
Optymalizacja metody analitycznej obejmuje testowanie stabilności analitów w roztworze wzorcowym i próbkach, a także sprawdzenie selektywności i określenie zakresu roboczego.
Walidacja metody
Walidacja metody jest warunkiem wstępnym uzyskania wiarygodnych wyników pod względem porównywalności i identyfikowalności. Walidacja metody musi być przeprowadzona oddzielnie dla każdego analitu docelowego we wszystkich wymaganych matrycach. Typowe charakterystyki wydajności, które należy ocenić podczas walidacji metody ilościowej, to granice wykrywalności (LOD), granice oznaczalności (LOQ), liniowość, precyzja, selektywność, odporność, dokładność, wpływ matrycy i odzyski. Walidacja metody może być przeprowadzona poprzez posypanie ślepych próbek każdym wymaganym analitem w zakresie stężeń w replikacji. Jeśli jest to możliwe, poprawność metody powinna zostać potwierdzona przy użyciu certyfikowanych materiałów referencyjnych. Ponadto materiały dopasowane do matrycy i udział w testach biegłości umożliwiają dodatkowe zapewnienie jakości. Między innymi ograniczona liczba materiałów referencyjnych jest odpowiedzialna za półilościowy charakter takich metod przesiewowych. Chociaż metody wielotoksynowe są już wdrażane w rutynowych analizach, należy wziąć pod uwagę wysokie koszty inwestycji i utrzymania.
Wdrożenie metody
Podczas wdrażania, próbki rzeczywiste, jak również próbki kontroli jakości powinny być mierzone za pomocą zwalidowanej metody. Ponadto zwalidowana metoda powinna zostać wdrożona i stosowana w rutynowych laboratoriach, co może być trudne pod względem dostępności personelu laboratoryjnego i oprzyrządowania.
Ogólne wyzwania związane z oznaczaniem mikotoksyn
Zwykle zanieczyszczenia mikotoksynami są heterogenicznie rozmieszczone w uprawach rolnych i mogą być skoncentrowane w "gorących punktach". Dlatego pobieranie próbek jest ważnym i kluczowym krokiem, ponieważ reprezentatywna próbka jest niezbędna do precyzyjnego i dokładnego określenia poziomów mikotoksyn. W przypadku większości technik analitycznych nie można osiągnąć bezpośredniego wykrycia mikotoksyn w próbkach zmielonych zbóż, dlatego wymagane są procedury przygotowania próbek.
Kolejnym ważnym krokiem jest ekstrakcja próbki. Podczas konwencjonalnej ekstrakcji ciało stałe-ciecz, mikotoksyny są ekstrahowane ze zmielonych próbek zbóż poprzez mechaniczne wytrząsanie z różnymi mieszaninami rozpuszczalników (wodnych i organicznych), czasami również z modyfikatorami kwasowymi lub zasadowymi. Uzyskane ekstrakty mogą być następnie wykorzystane do analizy. Większość opracowanych metod analitycznych do celów regulacyjnych i naukowych opiera się na separacji chromatograficznej, głównie chromatografii cieczowej (LC), w połączeniu z różnymi detektorami. Detektory LC do ciągłego monitorowania i wykrywania analitów eluujących z kolumny chromatograficznej opierają się na pomiarach absorbancji UV/Vis, fluorescencji i spektrometrii mas (MS). Ze względu na różne właściwości chemiczne i fizykochemiczne mikotoksyn, większość takich metod analitycznych została zoptymalizowana pod kątem jednego związku docelowego lub w najlepszym przypadku grupy blisko spokrewnionych mikotoksyn. Ponadto te ukierunkowane metody często obejmują etapy ekstrakcji i oczyszczania w celu zmniejszenia lub wyeliminowania niepożądanych składników matrycy. W związku z tym generowane oszacowanie występowania zawsze zależy od analizowanych próbek, a także mikotoksyn objętych stosowanymi metodami analitycznymi.
Wnioski
Podsumowując, opracowanie metody oznaczania wielu mikotoksyn w oparciu o LC-MS/MS jest wyzwaniem, gdy celem jest uzyskanie wiarygodnych i porównywalnych danych ilościowych. Ogromna liczba różnych parametrów, które znacząco wpływają na jakość i wiarygodność wyników, musi być dokładnie rozważona dla każdego analitu w każdej matrycy osobno. Ponadto różnorodność chemiczna mikotoksyn oznacza, że podczas opracowywania metody należy pójść na kompromis, który może być daleki od optymalnego dla niektórych analitów. Co więcej, szeroki zakres towarów rolnych, a także różne zakresy stężeń i różne rozkłady występowania stanowią dodatkowe wyzwanie dla rozwoju i optymalizacji metod. Niemniej jednak opracowanie metod oznaczania wielu mikotoksyn jest z pewnością konieczne, a postęp w tej technologii jeszcze bardziej rozszerzy jej zastosowanie.