Impedancyjna cytometria przepływowa i jej zastosowanie w monitorowaniu środowisk przetwarzania żywności
Opublikowano:
Mikrobiologia
Ten artykuł został opublikowany w Spot On #15
Są Państwo ciekawi, co Spot On ma do zaoferowania?
Proszę przeczytać teraz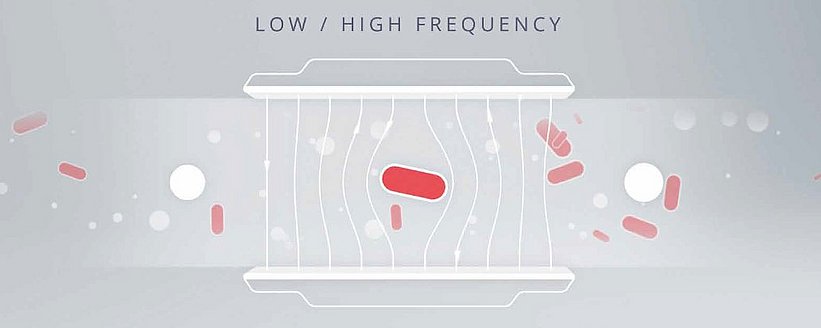
Czym jest cytometria przepływowa?
Cytometria przepływowa odnosi się do grupy technik, które wykorzystują laser lub pole elektryczne do zliczania komórek zawieszonych w płynie i określania niektórych ich właściwości fizycznych lub chemicznych. Optymalnie, tylko jedna komórka na raz przepływa przez mikroprzepływowy kanał cytometru, który wykrywa zmiany długości fali światła lub ładunku elektrycznego w miarę przechodzenia każdej komórki lub innych cząstek. Ponieważ cytometria przepływowa zazwyczaj wymaga dużych i drogich urządzeń, a także skomplikowanych etapów przygotowawczych, metoda ta była tradycyjnie ograniczona do zastosowań laboratoryjnych w dziedzinach takich jak badania i medycyna.
Opublikowano:
Mikrobiologia
Ten artykuł został opublikowany w Spot On #15
Są Państwo ciekawi, co Spot On ma do zaoferowania?
Proszę przeczytać teraz
Zastosowanie impedancyjnej cytometrii przepływowej do zliczania zarówno komórek, jak i pozostałości cząstek
Impedancyjna cytometria przepływowa wywodzi się z technologii leżącej u podstaw liczników cząstek Coultera, które mogą mierzyć i zliczać cząstki zawieszone w elektrolitach na podstawie zmian impedancji spowodowanych przemieszczaniem elektrolitów przez cząstki. Mierząc wiele częstotliwości w tym samym czasie dla każdej przechodzącej cząstki, impedancyjna cytometria przepływowa może rozróżniać cząstki nie tylko na podstawie rozmiaru, ale także właściwości elektrycznych. Jest to potężny wariant cytometrii przepływowej, ponieważ jest bardzo solidny i może być wykorzystywany do oceny cech komórkowych, które w przeciwnym razie są niemożliwe do zmierzenia bez użycia znaczników molekularnych, takich jak integralność błony komórkowej. Dlatego też, zamiast lasera, impedancyjny cytometr przepływowy wykorzystuje prąd zmienny, którego zmienne częstotliwości umożliwiają urządzeniu wykrywanie, pomiar wielkości i oddzielne zliczanie komórek nienaruszających błony i innych cząstek. W porównaniu z innymi urządzeniami do cytometrii przepływowej, impedancyjne cytometry przepływowe mogą być lekkie, przenośne i zasilane bateryjnie, dzięki czemu mogą być używane tam, gdzie pobierana jest próbka.

W jaki sposób impedancyjne cytometry przepływowe odróżniają komórki od innych cząstek?
Impedancyjna cytometria przepływowa wykorzystuje unikalne właściwości elektro-magnetyczne błony komórkowej i cytoplazmy w celu odróżnienia bakterii od innych cząstek. Błona komórkowa i cytoplazma wpływają na pole elektryczne w sposób, który różni się od innych cząstek w próbce. Przykład wykorzystujący cząstki metaliczne (przewodzące), cząstki nieprzewodzące i nienaruszone komórki może najlepiej zilustrować tę zasadę. Niezależnie od częstotliwości pola elektrycznego, przewodnictwo cząstek metalicznych pozwoli na niezakłócony przepływ pola elektrycznego. Przeciwnie, nieprzewodzące cząstki, takie jak polistyren, będą odporne na pole elektryczne; prąd będzie płynął tylko w ciekłym medium, co prowadzi do mierzalnego przesunięcia objętościowego skorelowanego z cząstkami w kanale przepływowym. Nienaruszone komórki są jednak wyjątkowe, ponieważ przypominają zarówno nieprzewodzące, jak i metaliczne cząstki, w zależności od częstotliwości pola elektrycznego. Przy niskich częstotliwościach izolująca jakość membrany komórki zapobiega przenikaniu przez nią pola elektrycznego, co prowadzi do tego samego rodzaju przemieszczenia, co w przypadku nieprzewodzących cząstek. Wyższe częstotliwości mogą jednak częściowo penetrować błonę; jako takie, komórki są podobne pod względem przewodnictwa do cząstek metalicznych. Mikroelektrody w impedancyjnych cytometrach przepływowych generują pola zarówno przy niskich, jak i wysokich częstotliwościach, umożliwiając urządzeniu wykrywanie tych zmian przewodności i oporu oraz przypisywanie ich w precyzyjnej liczbie do nienaruszonych komórek lub innych cząstek. Detektor identyfikuje cel jako bakterię na podstawie różnego stopnia impedancji lub przewodności przy tych częstotliwościach. Następnie użytkownik otrzymuje oddzielne zliczenia nienaruszonych komórek i innych cząstek.

Jak impedancyjna cytometria przepływowa wypada w porównaniu z metodami kulturowymi?
Metody hodowlane, w szczególności stosowanie płytek agarowych, są tradycyjnym podejściem do monitorowania stanu sanitarnego środowisk przetwarzania żywności. Jednak metody kulturowe, choć dobrze ugruntowane, mają kilka wad dotyczących ich szybkości i zakresu. Metody hodowlane są powolne, wymagają od jednego do dziesięciu dni, aby bakterie wyrosły na policzalne kolonie. Metody te mierzą tylko to, co można hodować w określonych warunkach danego testu; gatunek lub inna grupa bakterii może wymagać określonego agaru lub płynnego podłoża w dokładnej temperaturze, stopniu oświetlenia lub wilgotności, aby wymienić tylko kilka zmiennych. Metody kulturowe również nie mogą zapewnić kompleksowego pomiaru wszystkich bakterii w próbce. "Wielka anomalia liczenia płytek", zagadka dobrze znana w mikrobiologii, zauważa, że tylko niewielką część bakterii w środowisku można odzyskać poprzez hodowlę. Bakterie w stanie żywotnym, ale niekulturowalnym (VBNC) są żywe, ale z powodu stresu, idiosynkrazji lub mniej niż optymalnych czynników środowiskowych nie mogą rosnąć na agarze lub w pożywkach płynnych. W niektórych przypadkach można je hodować po reanimacji, co jest procesem czasochłonnym. Ponadto, bakterie beztlenowe i mikroaerofilne wymagają odpowiednio braku tlenu lub poziomu tlenu niższego niż w normalnych warunkach atmosferycznych. Bakterie z tych grup, które można hodować, wymagają specjalnych warunków inkubacji, co zwiększa koszty testów analitycznych. Impedancyjne cytometry przepływowe zliczają wszystkie bakterie, które przechodzą przez kanał przepływowy, niezależnie od ich stanu (hodowlane, VBNC, niekulturowalne, uśpione) lub wymagań dotyczących wzrostu. Taka bezpośrednia, natychmiastowa kwantyfikacja poszerza zakres programu kontroli higieny; bakterie, które nie namnażają się przed kontaktem z żywnością lub potencjalnymi żywicielami, mogą być również celem za pomocą impedancyjnej cytometrii przepływowej. Pozwala to również na podjęcie natychmiastowych działań, gdy czyszczenie i dezynfekcja nie przebiegają zgodnie z planem.