Mniejsze jest lepsze: Poprawa wyników analizy mikotoksyn poprzez zmniejszenie wielkości cząstek
Opublikowano:
Mikotoksyna
Ten artykuł został opublikowany w Spot On #13
Są Państwo ciekawi, co Spot On ma do zaoferowania?
Proszę przeczytać teraz
Najnowsze badania pokazują, że wielkość cząstek w próbce ma znaczący wpływ na dokładność metod analitycznych mikotoksyn. Eksperci ds. mikotoksyn, Henriette Hobbs i Nora Kogelnik, analizują ten problem i przedstawiają kilka zaleceń, które pozwolą utrzymać dokładność i wiarygodność Państwa testów na mikotoksyny.
Opublikowano:
Mikotoksyna
Ten artykuł został opublikowany w Spot On #13
Są Państwo ciekawi, co Spot On ma do zaoferowania?
Proszę przeczytać teraz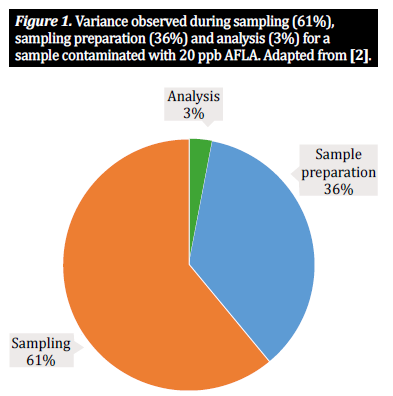
W społeczności analityków mikotoksyn, jeśli chodzi o towary rolne, takie jak kukurydza, pszenica i jęczmień, zazwyczaj pracujemy z trzema głównymi etapami proceduralnymi: pobieranie próbek, przygotowanie próbek i analiza. Aby określić stężenie mikotoksyn obecnych w partii luzem, musimy przeanalizować mniejszą, ale nadal reprezentatywną część partii; oznacza to, że wiarygodne wyniki są niemożliwe bez odpowiedniego planu pobierania próbek, który obejmuje pobieranie próbek przyrostowych partii i łączenie ich w podpróbkę (znaną również jako próbka zbiorcza). Stanowi to podstawę, która zapewnia, że badana próbka jest naprawdę reprezentatywna dla partii. Następnie skupiamy się na przygotowaniu próbki. W przypadku produktów ziarnistych przygotowanie próbki składa się z dwóch ważnych etapów: mielenia próbki i pobierania podpróbek: 1) młynek lub inne urządzenie służy do mielenia ziarna w próbce zbiorczej w celu zmniejszenia wielkości cząstek i zapewnienia jednorodności; 2) z tej próbki uzyskujemy podpróbkę reprezentatywną dla całej partii, którą następnie testujemy. Ta próbka testowa jest następnie przygotowywana do ekstrakcji zgodnie z określonym protokołem [10]. Jednak pobieranie i przygotowanie próbek to złożone procesy, pełne potencjalnych pułapek; każdy etap procesu przygotowania próbki wprowadza poziom zmienności, który przyczynia się do całkowitej zmienności w ramach pojedynczego wyniku analitycznego [2, 5]. Liczne badania wykazały, że dwie trzecie obserwowanej zmienności wynika z metody pobierania próbek, a jedną trzecią można przypisać sposobowi przygotowania próbki. Znacznie mniejszy procent zmienności odnosi się do zastosowanej metody analitycznej (rysunek 1). W związku z tym dokładne wyniki zależą od stopnia, w jakim weźmiemy pod uwagę te trzy czynniki. Podczas gdy liczne badania omawiają znaczenie metod pobierania próbek i rozpuszczalników analitycznych na efekt wykrywania mikotoksyn (patrz [1, 2, 4] dla najważniejszych przykładów), w tym artykule rozważymy znaczenie przygotowania próbki, tj. rozdrobnienia i wielkości próbki, a podsumowując ostatnie badania w tej sprawie, omówimy wpływ przygotowania próbki na dokładną analizę mikotoksyn i wariancję próbki [10].
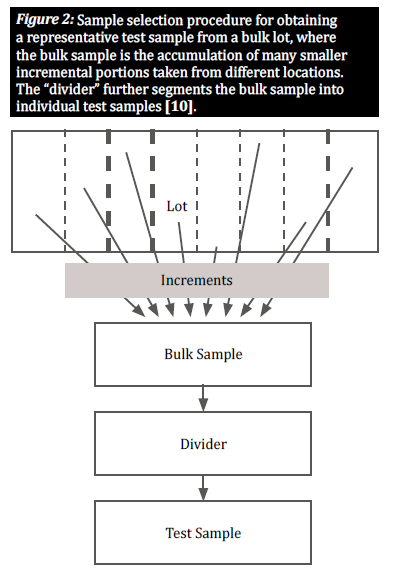
Proszę wybrać reprezentatywną próbkę
Gdy towar jest naturalnie zanieczyszczony mikotoksynami, zanieczyszczone ziarna są zazwyczaj rozmieszczone nierównomiernie w danej partii; te grupy zanieczyszczonych ziaren są znane jako "gorące punkty". Aby zapewnić dokładny obraz stopnia zanieczyszczenia partii, plan pobierania próbek musi uwzględniać losowe rozmieszczenie takich gorących punktów. Odbywa się to poprzez pobranie dużej liczby małych, przyrostowych próbek z różnych miejsc rozmieszczonych w całej partii w celu uzyskania reprezentatywnej próbki (rysunek 2) [8]. Wybór próbek przyrostowych z partii masowej ma kluczowe znaczenie dla zapewnienia wszystkim ziarnom równych szans na wybór, zmniejszając w ten sposób stronniczość [10].
Mielenie w celu zapewnienia jednolitej wielkości cząstek
Pleśnie wytwarzające mikotoksyny mają kilka różnych dróg zakażenia; w rezultacie mikotoksyny można znaleźć zarówno wewnątrz ziaren, jak i na ich powierzchni. Droga zakażenia zależy od mikotoksyny i danego ziarna. Powszechnie wiadomo, że niektóre grzyby wytwarzające mikotoksyny, takie jak Fusarium, są obecne wewnątrz ziarna lub jądra, podczas gdy inne, takie jak Aspergillus, są obecne na powierzchni. Równomierne rozdrobnienie próbki rozwiązuje ten problem, rozbijając zanieczyszczone ziarna i umożliwiając równomierne rozprowadzenie cząstek. To ostatecznie poprawia wykrywanie zanieczyszczonych cząstek [3].
Homogenizacja potencjalnego rozkładu mikotoksyn poprzez przepuszczenie ziarna przez siatkę i wymieszanie.
Po wybraniu próbki, która ma być reprezentatywna dla partii i zmieleniu jej w celu zapewnienia jednolitej wielkości cząstek, próbkę należy zhomogenizować poprzez dokładne wymieszanie; pomaga to również uczynić ją reprezentatywną dla próbki zbiorczej [3]. Ziarna segregują się w zależności od wielkości, zmniejszając stopień reprezentatywności próbki i prowadząc do niedokładnych wyników analitycznych. Z tego powodu przed mieszaniem potwierdzamy, że jednorodność mielenia jest odpowiednia, przepuszczając zmieloną próbkę przez siatkę lub sito. Celem nie jest odfiltrowanie większych cząstek, ponieważ mogą one również zawierać mikotoksyny; wręcz przeciwnie, te większe cząstki muszą być zawarte w próbce. Zapewniamy raczej jednorodność mielenia, sprawdzając, czy pewien procent cząstek jest w stanie przejść. Na przykład USDA-FGIS ustaliła specyfikacje dotyczące wielkości próbki, rozdrabniania próbki i pobierania próbek aflatoksyny, deoksyniwalenolu, fumonizyny, ochratoksyny i zearalenonu [9]. USDA-FGIS zaleca, aby próbka została zmielona tak, aby 60-75% cząstek przeszło przez sito nr 20 i aby 50 g próbki testowej (w tym cząstki, które nie przeszły przez sito) zostało użyte do ekstrakcji mikotoksyny.
Proszę zachować mały rozmiar ziarna, duży rozmiar próbki i dokładne wyniki dotyczące mikotoksyn
W całym tym artykule używamy terminów "dokładność" i "precyzja", więc krótka definicja tych terminów jest tutaj w porządku: dokładność i precyzja oznaczają niepewności związane z analizą, które można wprowadzić z początkowej metody przygotowania próbki lub planu. Dokładność definiuje się jako bliskość zmierzonej wartości do wartości rzeczywistej, podczas gdy precyzję definiuje się jako bliskość zmierzonych wartości względem siebie. Ostatecznym celem powinno być wdrożenie procesu zapewniającego zarówno wysoką dokładność, jak i wysoką precyzję [10]. Badania pokazują, że precyzja metody wykrywania mikotoksyn, a tym samym wariancja wyników, zależy w dużej mierze od wielkości cząstek w próbce. Aby zademonstrować zmienność pomiaru związaną z wielkością cząstek w próbce i wielkością analizowanej próbki, odnosimy się do kilku badań, które to oceniały (rysunek 3 i rysunek 4). W pierwszym badaniu przeprowadzonym przez Whitaker et al. (pokazanym na rysunku 3) scharakteryzowano próbki kukurydzy naturalnie zanieczyszczone aflatoksyną. Próbki ziaren o różnej wielkości zostały następnie przepuszczone przez sito nr 20: 1) grubo zmielone (60% cząstek przeszło), 2) drobno zmielone (99% cząstek przeszło) i 3) sproszkowane (za pomocą młyna młotkowego). Osiem próbek z każdego przedziału mielenia zostało następnie przeanalizowanych przy użyciu zmodyfikowanej metody referencyjnej HPLC w celu wykazania wariancji między próbkami w obrębie jednego stanu zmielenia [9].
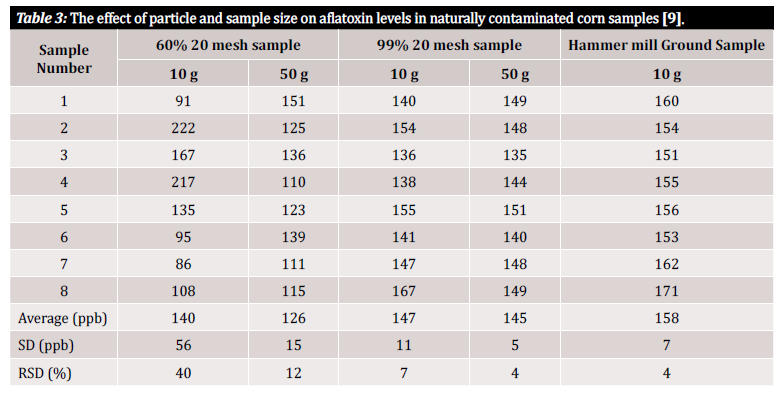
Jak widać w tabeli 3, wyniki analityczne różnią się w zależności zarówno od wielkości próbki, jak i wielkości rozdrobnienia. Jak jednak możemy określić ilościowo tę zmienność w użyteczny dla nas sposób? Względne odchylenie standardowe (RSD) lub współczynnik zmienności (CV) są często używane do określenia, jak różne są wyniki w danym zestawie danych. RSD jest często deklarowane jako wartość procentowa i jest definiowane przez stosunek odchylenia standardowego do średniej. Im niższe odchylenie standardowe, tym mniejsza zmienność w zestawie danych i tym bardziej wiarygodny wynik. W danych z badania przedstawionych w tabeli 3 zaobserwowano znaczną zmienność między próbkami o masie 10 g składającymi się z różnych rozmiarów cząstek. 10 g grubo zmielonych próbek wykazuje 40% najwyższy RSD w porównaniu z drobniej zmieloną próbką (99% próbka 20 mesh), z obliczonym RSD wynoszącym 7%. Najniższy RSD, 4%, został osiągnięty w przypadku sproszkowanych próbek z młyna młotkowego. Chociaż młyn młotkowy może zazwyczaj nie być finansowo wykonalny dla przeciętnego testera, badanie przeprowadzone przez Whitakera i in. pokazuje, że najlepszym sposobem na uniknięcie wariancji pochodzących z przygotowania próbki jest dokładne zmielenie i użycie siatki w celu zapewnienia jednorodności wielkości cząstek [9].
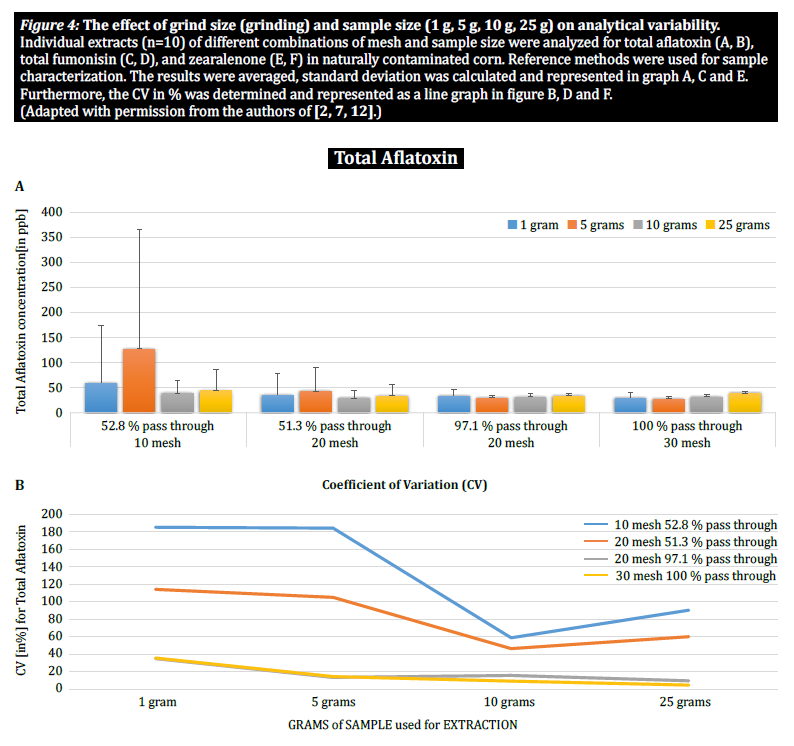
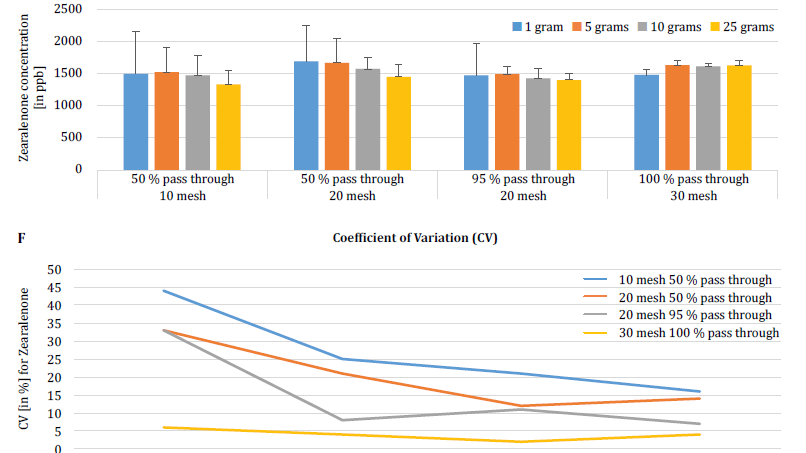
W celu dalszego wykazania wpływu wielkości cząstek (mielenia) i wielkości próbki na zmienność analityczną różnych mikotoksyn, Brunkhorst i in. przeprowadzili analizę próbek kukurydzy naturalnie zanieczyszczonych całkowitą aflatoksyną (suma B1, B2, G1 i G2), całkowitą fumonizyną (suma B1, B2 i B3) lub zearelenonem (rysunek 4). W tym badaniu 10 próbek kukurydzy dla każdej mikotoksyny zostało zmielonych do różnych rozmiarów cząstek, aby umożliwić im przejście przez sito nr. 10, sito nr 20 lub sito nr. 30. Zbadano również wariancję różnych wielkości próbek (1 g, 5 g, 10 g i 25 g) do ekstrakcji. Próbki aflatoksyn ekstrahowano acetonitrylem/wodą (84/16) i analizowano przy użyciu metody AOAC i celi KOBRA do bromowania po kolumnie. Próbki fumonizyny ekstrahowano metanolem/wodą (3/1) i również analizowano zgodnie z metodą AOAC. Próbki zearealenonu również ekstrahowano acetonitrylem/wodą i analizowano przy użyciu LC-MS/MS. Uwaga: Dane przedstawione na każdej parze wykresów są nieco zbędne. Uważamy jednak za przydatne przedstawienie współczynnika zmienności na osobnym wykresie. Wyniki wyraźnie pokazują, że wielkość rozdrobnienia i wielkość próbki mają wpływ na dokładność analizy. Badanie sugeruje, że AFLA i ZON wykazują wyższy stopień zależności (tj. wyższy współczynnik zmienności) od objętości próbki i wielkości mielenia niż FUM, chociaż wahamy się wyciągnąć ostateczne wnioski z tych indywidualnych badań; potrzebne są dalsze badania, aby potwierdzić naszą obserwację. Dla próbek o wielkości 1 g i 5 g, RSD dla AFLA, FUM i ZON były wyższe w porównaniu do próbek o wielkości 10 g i 25 g. Zmienność obserwowana dla 10 g próbki kukurydzy zanieczyszczonej AFLA spadła z 58,9% (grubo zmielonej) do 9,3% (drobno zmielonej), dla FUM z 39,8% (grubo zmielonej) do 4,6% (drobno zmielonej), a dla ZON z 21% (grubo zmielonej) do 2% (drobno zmielonej). Wyniki te dodatkowo potwierdzają wpływ wielkości mielenia na wariancję analityczną i dokładność w odniesieniu do ekstrakcji i analizy mikotoksyn z ziaren.
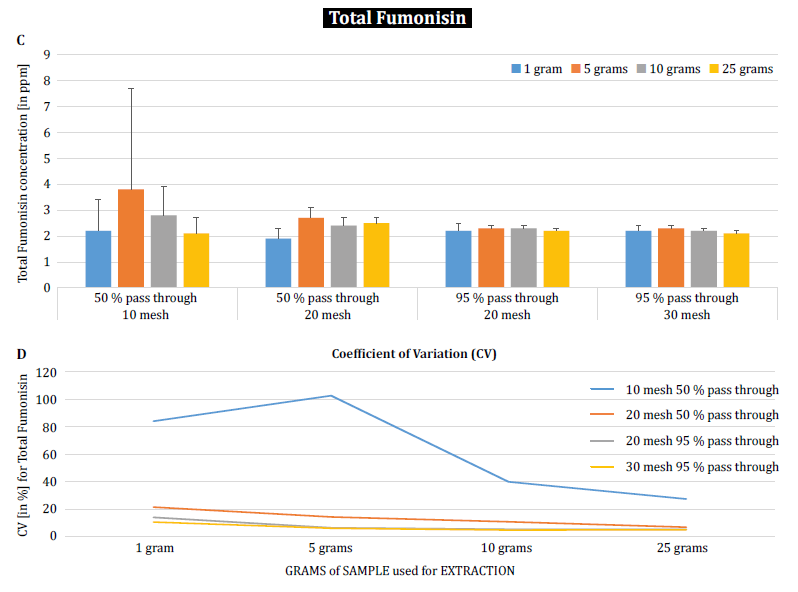
Wreszcie, Brunkhorst i in. wyjaśnili swoje odkrycia i określili poziomy deoksyniwalenolu w naturalnie zanieczyszczonych próbkach jęczmienia w tym samym zarysie badania. Próbki jęczmienia zmielono do czterech różnych rozmiarów oczek, ekstrahowano (10 indywidualnych ekstraktów dla każdego rozmiaru oczek i próbki) przy użyciu acetonitrylu/wody (84/16) i analizowano za pomocą LC-MS-MS (rysunek 5) [6]. Wyniki wyraźnie pokazują, że zmienność analityczną można zmniejszyć, gdy próbki są mielone w celu przejścia przez drobniejsze oczka. Ponadto zwiększenie rozmiaru próbki dodatkowo pomaga zmniejszyć zmienność analityczną. Współczynnik zmienności udało się zmniejszyć z 11% do zaledwie 5% przy użyciu próbki 10 g z siatką nr. 10 mesh. Wielkość próbki 10 g i 25 g w połączeniu z siatką nr 20 (95%) i nr. 30 mesh (95%) zapewnia dokładne i precyzyjne wyniki, zmniejszając CV odpowiednio do 5% i 3%. Ponieważ w tym badaniu wykorzystano jęczmień zamiast kukurydzy, sugeruje to, że wpływ wielkości próbki i rozdrobnienia na zmienność analityczną mikotoksyn może nie zależeć od matrycy. Aby to potwierdzić, konieczne są dalsze badania [6].
Wnioski: Siatkować, mieszać, powtarzać w razie potrzeby
Znaczenie rozdrabniania i wielkości próbki, a także wpływ tych czynników na zmniejszenie zmienności i minimalizację błędów podczas analizy mikotoksyn jest oczywisty. W przedstawionych badaniach zaobserwowano znaczne różnice między grubo i drobno zmielonymi próbkami z tego samego źródła i poziomu zanieczyszczenia. Poza prostą obserwacją zmienności, dane z tych badań sugerują pewne wstępne podejścia do wielkości próbki i mielenia. Jeśli chodzi o wielkość próbki, 10 g okazało się wystarczające, podczas gdy 25 g może zapewnić jeszcze większą dokładność. Przy użyciu siatki nr 20, 95% próbki powinno przejść. Przy użyciu siatki nr. 30, powinno przejść 100% próbki. Głównym celem analizy mikotoksyn jest uzyskanie dokładnych i wiarygodnych wyników pomimo trudności w pobieraniu próbek i złożoności przygotowania próbek ziarna i upraw. Jednak nawet najlepsza technologia, czy to w postaci najnowocześniejszych szybkich testów, czy wysoce precyzyjnego sprzętu do spektrometrii mas, nie przyniesie żadnych rezultatów, jeśli Państwa próbka nie jest reprezentatywna dla badanej partii. Reprezentatywna próbka to coś więcej niż tylko pobranie próbki; przygotowanie próbki jest kluczowe. Jeśli będą Państwo przestrzegać trzech kluczowych czynników przygotowania próbki (wielkość rozdrobnienia, wielkość próbki i jednorodność), można utrzymać RSD na poziomie <10%, zwiększając wiarygodność wyników analitycznych.